Contoh Soal Ikatan Kovalen
Contoh Soal Ikatan Kovalen - Ikatan kovalen adalah sejenis ikatan kimia, yakni satu atau lebih pasangan elektron valensi digunakan bersama antara atom, dengan demikian atom tersebut menjadi milik bersama. Ikatan kovalen sangat mungkin terjadi antara atom yang mempunyai kesamaan elektronegativitas, atau kemampuan untuk menarik elektron menuju inti atom, dan dapat terbentuk di antara atom dari unsur yang sama. Hanya unsur nonlogam yang membentuk ikatan kovalen

Beberapa senyawa kovalen membentuk struktur makromolekul, yakni molekul berukuran cukup besar yang dapat dilihat dengan mata telanjang, seperti kekisi atau lembaran kovalen. Karbon mungkin akan membentuk senyawa seperti itu, karena empat elektron valensinya cocok untuk berikatan dengan atom karbon lainnya.
Elektron digunakan bersama dalam senyawa kovalen untuk melengkapi kulit elektron terluar. Misalnya, atom-atom hidrogen berisi satu elektron, tetapi berpotensi mempunyai dua elektron. Karena itu, pada gas hidrogen (H2), dua atom tersebut menggunakan bersama dua elektron pada kulit elektron terluar mereka. Unsur-unsur yang lebih besar dapat mempunyai total delapan elektron valensi. Misalnya, pada gas metana (CH4) terjadi penggunaan bersama empat pasang elektron: satu pasang atom karbon berpasangan dengan tiap empat atom hidrogen.

Metana, CH4, adalah molekul yang terikat secara kovalen
Bagaimana Terjadi Ikatan Rangkap dalam Senyawa Kovalen?
Senyawa kovalen dapat terbentuk dari ikatan rangkap antara dua atom melalui penggunaan bersama lebih dari satu pasangan elektron. Ikatan tunggal antara dua atom terjadi dalam bentuk ikatan sigma. Orbit elektron secara langsung tumpang tindih dalam suatu ikatan sigma, yang menjadikannya sebagai jenis ikatan kovalen yang paling kuat. Ketika terbentuk ikatan rangkap, seperti dalam senyawa etilena, H2C=CH2, satu pasang elektron digunakan bersama dalam ikatan sigma, dan pasangan kedua digunakan bersama dalam ikatan pi. Orbital-orbital ini saling berdekatan, tidak tumpang tindih, sehingga ikatan pi lebih lemah daripada ikatan sigma. Ikatan rangkap tiga dapat pula terbentuk dalam kasus tertentu, misalnya, pada hidrogen sianida, HC≡N. Ikatan rangkap tiga terdiri atas satu ikatan sigma dan dua ikatan pi yang saling tegak lurus.
Bentuk-Bentuk Struktural Apakah yang Bersenyawa dengan Ikatan Kovalen?
Atom-atom dengan elektronegativitas yang sangat mirip menghasilkan molekul non-polar. Pada molekul nonpolar, terjadi distribusi elektron secara merata antara atom. Misalnya, gas hidrogen (H2) tergolong nonpolar. Jika terdapat perbedaan elektronegativitas, molekul polar akan terbentuk dengan lebih banyak atom elektronegatif yang sedikit bermuatan negatif, dan atom-atom kurang elektronegatif yang sedikit bermuatan positif. Misalnya, pada molekul air (H2O), oksigen lebih elektronegatif dan bermuatan negatif parsial, sedangkan atom hidrogen sedikit bermuatan positif. Secara keseluruhan, molekul air masih netral. Jika dua atom mempunyai perbedaan elektronegativitas terlalu besar, justru akan terbentuk ikatan ion, seperti yang dibahas dalam pelajaran lain. Senyawa kovalen yang terbentuk sebagai molekul tersendiri dapat berupa padatan, cairan, atau gas pada suhu kamar dan bahkan, padatan tersebut cenderung mempunyai titik lebur relatif rendah.
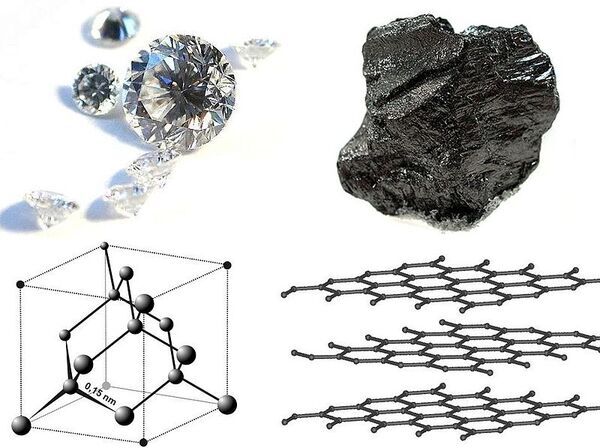
Beberapa senyawa kovalen membentuk struktur makromolekul, yakni molekul berukuran cukup besar yang dapat dilihat dengan mata telanjang, seperti kekisi atau lembaran kovalen. Karbon mungkin akan membentuk senyawa seperti itu, karena empat elektron valensinya cocok untuk berikatan dengan atom karbon lainnya.
Grafit membentuk lembaran teratur berbentuk datar dan menyerupai sarang lebah yang dapat bergeser satu sama lain, yang menjadikannya bermanfaat ketika digunakan pada pensil untuk menulis. Sebaliknya, intan berisi atom karbon yang terikat secara tetrahedral dan membentuk struktur kekisi intan, suatu pola perulangan delapan atom yang menghasilkan bentuk kristal tiga dimensi.
Senyawa yang terdiri atas kekisi kovalen mempunyai kemiripan sifat dengan senyawa ion, seperti, padat pada suhu kamar, cenderung rapuh, dan mempunyai titik lebur dan titik didih tinggi. Namun, tidak seperti senyawa ion, senyawa kovalen tidak menghantar listrik atau panas dengan baik. Pada umumnya, semua senyawa kovalen cenderung tidak mudah larut dalam air dibanding senyawa ion, dengan senyawa polar yang mempunyai kelarutan lebih besar daripada senyawa nonpolar.
S1
Apa itu molekul nonpolar?
S2
Unsur berikut ini yang paling mungkin membentuk empat rantai kovalen adalah ....
S3
Manakah dari senyawa berikut ini yang paling mudah larut dalam air?
S4
Mungkinkah besi cenderung membentuk senyawa kovalen? Mengapa mungkin, atau mengapa tidak?
S5
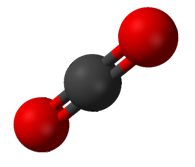
Berapa banyak pasangan elektron yang digunakan bersama oleh tiap atom oksigen dengan karbon dalam senyawa karbon dioksida (CO2)?

S6
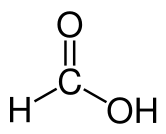
Jenis-jenis ikatan kovalen apakah yang terdapat dalam molekul asam format, HO-C (= O) H, dan berapakah jumlah ikatan yang ada pada tiap-tiap jenis?
(Tanda kurung menunjukkan bahwa oksigen berikatan rangkap hanya dengan atom karbon)
(Tanda kurung menunjukkan bahwa oksigen berikatan rangkap hanya dengan atom karbon)

S7
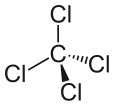
Mengingat klorin memiliki tujuh elektron valensi, molekul kovalen manakah yang kemungkinan besar akan terbentuk?

S8
Apa perbedaan utama antara ikatan sigma dan ikatan pi?
S9
Seorang siswa telah mengisolasi suatu senyawa padatan dalam laboratorium. Percobaan manakah yang merupakan cara terbaik untuk menguji apakah zat itu adalah senyawa kovalen nonpolar atau jenis senyawa lain?
S10
Mengapa grafit berbentuk lapisan molekul, sementara intan berbentuk kristal tiga dimensi?

