Contoh Soal Benzena
Contoh Soal Benzena - Senyawa benzena pertama kali ditemukan oleh Michael Faraday pada tahun 1925. Pada saat itu, belum diketahui secara pasti bagaimana struktur molekulnya. Berdasarkan jumlah atom karbon dan hidrogennya, benzena merupakan senyawa hidrokarbon tak jenuh. Namun, hasil penelitian menunjukkan bahwa benzena tidak dapat mengalami reaksi adisi oleh brom dalam keadaan RTP sebagaimana senyawa hidrokarbon tak jenuh umumnya. Akhirnya, pada tahun 1965 seorang ilmuwan yang bernama Friedrich August Kekulé berhasil menggambarkan rumus struktur benzena seperti yang akan kalian pelajari pada penjelasan berikut ini.

✮✮✮ Struktur Benzena ✮✮✮
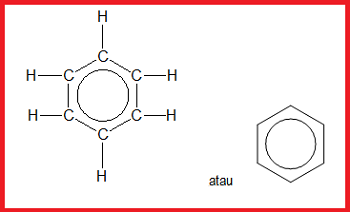
Benzena adalah senyawa hidrokarbon yang memiliki rumus molekul C₆H₆. Benzena terdiri atas enam atom karbon yang membentuk cincin segienam (heksagonal) dengan sudut 120⁰. Selain itu, benzena memiliki ikatan rangkap yang berselang-seling. Ikatan rangkap yang berselang-seling dalam molekul benzena dapat digambarkan dengan 2 cara, yaitu sebagai berikut.

Menurut Friedrich August Kekulé, ikatan tunggal dan ikatan rangkap pada struktur benzena mempunyai panjang ikatan yang berbeda. Ikatan tunggal panjangnya 0,154 nm dan ikatan rangkap panjangnya 0,134 nm. Akan tetapi, hasil eksperimen menunjukkan bahwa semua ikatan dalam benzena mempunyai panjang yang sama yaitu 0,139 nm. Oleh karena itu, pada tahun 1931, Linus Pauling mengusulkan struktur resonansi pada molekul benzena. Struktur benzena digambarkan secara hybrid dalam bentuk lingkaran atau cincin sebagai berikut.

✮✮✮ Sifat Fisika Benzena ✮✮✮
Benzena dikenal sebagai senyawa aromatik karena pada awal ditemukannya, sebagian besar senyawa benzena memiliki aroma yang khas, misalnya vanili.

Titik leleh benzena (6°C) lebih tinggi dibandingkan heksana (–95°C). Hal ini terjadi karena benzena memiliki struktur yang lebih simetris dibandingkan senyawa alifatik serupa. Benzena bersifat nonpolar seperti hidrokarbon alifatik dan alisiklik. Benzena tidak larut dalam air, tetapi larut dalam pelarut organik, seperti dietil eter, karbon tetraklorida, atau heksana.
✮✮✮ Sifat Kimia Benzena ✮✮✮
Struktur benzena yang mengandung ikatan tunggal dan ikatan rangkap berselang-seling memberikan kestabilan yang tinggi pada benzena. Hal ini juga yang menyebabkan benzena tidak dapat mengalami reaksi adisi seperti senyawa lain yang memiliki ikatan rangkap.
Jenis reaksi kimia pada benzena umumnya adalah reaksi substitusi. Reaksi substitusi dapat berlangsung pada suhu tinggi, atau menggunakan katalis agar dapat berlangsung pada suhu lebih rendah.
Jenis reaksi kimia pada benzena umumnya adalah reaksi substitusi. Reaksi substitusi dapat berlangsung pada suhu tinggi, atau menggunakan katalis agar dapat berlangsung pada suhu lebih rendah.
✮✮✮ Reaksi-Reaksi pada Benzena ✮✮✮
Benzena merupakan senyawa yang kaya elektron, terutama pada bagian cincinnya. Akibatnya, jenis pereaksi yang menyerang cincin benzena adalah pereaksi yang suka elektron, atau disebut elektrofil. Contohnya adalah golongan halogen dan asam sulfat. Jenis reaksi yang umum pada benzena adalah reaksi substitusi, yaitu salah satu atau lebih atom H digantikan oleh atom atau gugus lain. Selain itu, jenis reaksi yang dapat terjadi pada senyawa benzena adalah reaksi adisi. Reaksi adisi tidak dapat terjadi dengan spontan pada keadaan ruangan biasa. Adisi hanya dapat terjadi dengan kondisi khusus, yaitu pada suhu dan tekanan tinggi.
Berikut ini adalah beberapa jenis reaksi substitusi pada benzena.
1. Reaksi Halogenasi
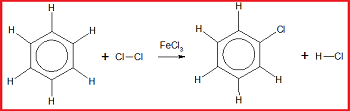
Reaksi halogenasi merupakan reaksi substitusi atom H pada benzena oleh golongan halogen seperti F, Cl, Br, I dengan bantuan katalis besi (III) halida.
Contoh: reaksi antara benzena dengan Cl₂ dengan bantuan katalis FeCl₃

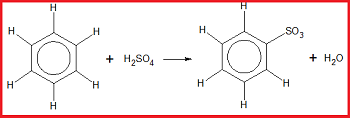
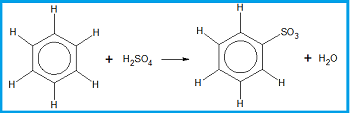
2. Reaksi Sulfonasi
Reaksi sulfonasi merupakan reaksi substitusi atom H pada benzena oleh gugus sulfonat. Pada reaksi ini, benzena dipanaskan dengan asam sulfat pekat sebagai pereaksi.

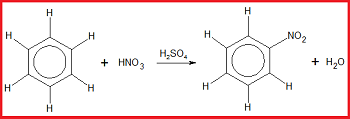
3. Reaksi Nitrasi
Reaksi nitrasi merupakan reaksi substitusi atom H pada benzena oleh gugus nitro. Pada reaksi ini, benzena bereaksi dengan asam nitrat dibantu katalis asam sulfat pekat.

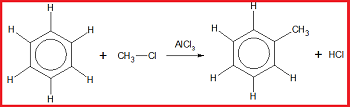
4. Reaksi Alkilasi Friedel-Crafts
Reaksi alkilasi Friedel-Crafts merupakan reaksi substitusi atom H pada benzena oleh gugus alkil dengan katalis alumunium klorida (AlCl₃).
Contoh: reaksi antara benzena dengan CH₃Cl dengan bantuan katalis AlCl₃

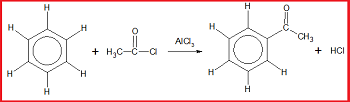
5. Reaksi Asilasi Friedel-Crafts
Reaksi asilasi Friedel-Crafts merupakan reaksi substitusi atom H pada benzena oleh gugus asil dengan bantuan katalis aluminium klorida (AlCl₃).
Contoh: reaksi antara benzena dengan CH₃COCl dengan bantuan katalis AlCl₃.

✮✮✮ Kegunaan Benzena ✮✮✮
Benzena dibuat dari minyak bensin (gasolin) yang mengandung atom C₅ sampai C₁₀. Secara umum, benzena digunakan sebagai pelarut organik untuk sulfur, fosfat, iodin, dan lemak. Benzena juga digunakan dalam industri parfum, dan obat-obatan. Selain itu, benzena juga digunakan untuk bahan dasar pembuatan senyawa turunan benzena seperti fenol, toluena, dan lainnya dengan cara reaksi substitusi. Benzena juga merupakan bahan baku untuk mensintesis berbagai senyawa karbon lain yang berbentuk polimer, seperti polimerisasi dari stirena (C₆H₆ – CH = CH₂) membentuk polistirena (karet sintesis).
S1
Benzena merupakan senyawa hidrokarbon yang terdiri atas 6 atom karbon dan 6 atom hidrogen dengan susunan ....
S2
Ilmuwan yang berjasa menemukan struktur benzena adalah ....
S3
Pernyataan berikut ini yang tidak benar mengenai benzena adalah .…
S4
Benzena (C₆H₆) dan heksana (C₆H₈) sama-sama memiliki 6 atom karbon, tetapi titik leleh benzena lebih tinggi daripada heksana. Hal ini disebabkan oleh ....
S5
Reaksi yang paling banyak terjadi pada benzena adalah reaksi ....
S6
Jika benzena direaksikan dengan gas dari golongan halogen, akan terjadi reaksi ....
S7

Gambar di atas menunjukkan reaksi ....
S8
Jika benzena direaksikan dengan campuran asam sulfat pekat dan asam nitrat, akan terjadi reaksi ....
S9
Perbedaan reaksi alkilasi dan asilasi adalah ....
S10
Senyawa benzena banyak digunakan dalam berbagai bidang kehidupan. Salah satunya adalah sebagai pelarut organik. Benzena dapat menjadi pelarut organik karena ....
