Contoh Soal Reaksi Kimia Eksotermis dan Endotermis
Contoh Soal Reaksi Kimia Eksotermis dan Endotermis - Reaksi kimia yang melepaskan energi disebut reaksi eksotermis. Reaksi kimia yang menyerap energi disebut reaksi endotermis.
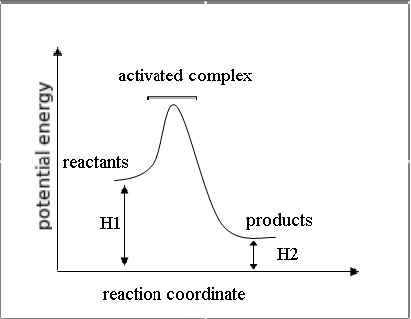
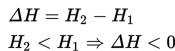
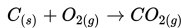
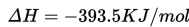
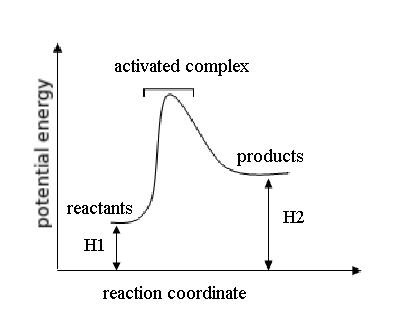
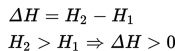
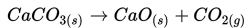
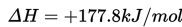
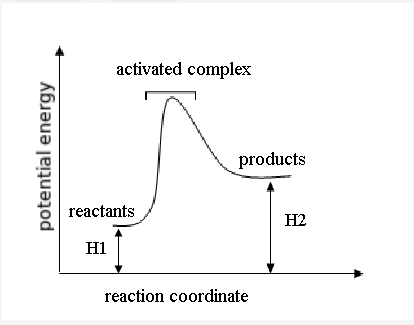
Sesuai dengan Hukum Lavoisier-Laplace :Jumlah panas yang dibutuhkan untuk memecah senyawa menjadi elemen konstituen adalah sama dengan panas
yang dibutuhkan untuk membangun senyawa dari elemennya. Atau perubahan entalpi yang terjadi pada reaksi satu arah adalah sama, namun memiliki tanda yang berlawanan karena dibandingkan dengan perubahan entalpi pada reaksi yang berlawanan arah. Oleh karena itu, jika kita mempunyai reaksi reversibel, jika reaksi langsung (searah) adalah endotermis maka reaksi tidak langsung (berlawanan) adalah eksotermis, begitu juga sebaliknya.
yang dibutuhkan untuk membangun senyawa dari elemennya. Atau perubahan entalpi yang terjadi pada reaksi satu arah adalah sama, namun memiliki tanda yang berlawanan karena dibandingkan dengan perubahan entalpi pada reaksi yang berlawanan arah. Oleh karena itu, jika kita mempunyai reaksi reversibel, jika reaksi langsung (searah) adalah endotermis maka reaksi tidak langsung (berlawanan) adalah eksotermis, begitu juga sebaliknya.
Reaksi eksotermis sering terjadi secara spontan dan menghasilkan entalpi negatif pada sistem. Ini berarti bahwa energi panas hilang di sekelilingnya.
Contoh reaksi eksotermis:

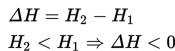
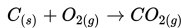
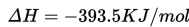
Reaksi ini adalah reaksi eksotermis karena reaktan lebih banyak menyimpan energi (total entalpi lebih besar) daripada produk dan oleh karenanya energi yang dilepas ke lingkungan sekelilingnya sebagai panas. Jadi, pada kasus ini kita tuliskan bahwa ΔH adalah -395.5 kJ/mol. Mengapa negatif? Angka negatif dikarenakan energi hilang dari sistem dan dilepaskan ke sekelilingnya. Dalam hal ini, kita definisikan reaktan kita sebagai sistem dan udara dimana panas dilepaskan sebagai lingkungan sekitar. Contoh lain dari reaksi eksotermis adalah pengaratan besi dan pembakaran kayu.
Contoh dari reaksi endotermis:

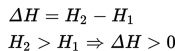
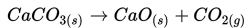
Reaksi endotermis harus menyerap energi dari lingkungan sekitarnya karena produk lebih menyimpan banyak energi (lebih banyak total entalpi) daripada reaktan. Mereka berasosiasi dengan entalpi positif, artinya panas masuk ke dalam sistem. Fotosintesa adalah contoh dari reaksi endotermis. Energi dari matahari penting untuk reaksi ini.
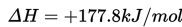
S1
Apakah perbedaan antara reaksi eksotermis dan endotermis?
S2
Manakah pernyataan di bawah ini yang TIDAK berasosiasi dengan reaksi eksotermis?
S3
Dalam sebuah reaksi reversibel, jika reaksi langsung (searah) adalah endotermis maka reaksi tidak langsung (berlawanan) adalah _________________.
S4
Pada reaksi eksotermis energi yang dilepaskan dapat berupa __________:
S5
„Jumlah energi yang ada di alam akan selalu tetap sama.“ Pernyataan ini dibuat berdasarkan_________________:
S6
Perbedaan dalam entalpi antara reaktan dan produk reaksi menunjukkan______:
S7
Jika perubahan entalpi lebih besar daripada nol (ΔH>0) maka reaksi ini adalah_________:'
S8
"Perubahan entalpi terjadi dalam reaksi pada satu arah adalah sama, namun memiliki tanda berlawanan dibandingkan perubahan entalpi dalam reaksi ke arah berlawanan." Pernyataan ini dibuat berdasarkan _________________:
S9
Jika reaktan memiliki total entalpi lebih besar daripada produknya, maka energi akan ________.
S10
Apakah besaran perubahan entalpi dalam reaksi yang terdapat pada grafik berikut?

