Contoh Soal Perhitungan Termokimia
Contoh Soal Perhitungan Termokimia - Termokimia adalah suatu ilmu bagian dari termodinamika kimia yang mempelajari perpindahan panas pada saat terjadi suatu reaksi kimia maupun fisika. Ilmu ini merupakan penerapan hukum termodinamika yang pertama. Manfaat mempelajari termokimia yaitu agar kita dapat memperkirakan jumlah reaktan dan produk yang terlibat dalam suatu reaksi. Persamaan Termokimia hampir sama dengan persamaan stoikiometri, hanya ditambah dengan menyertakan perubahan entalpi, ΔH.
O 2 ⇄ Δ H f = 393.5 k J / m o l Δ H f = − 393.5 k J / m o l C O 2
H f ( 2 C O 2 ) = − 393.5 k J / m o l ⋅ 2 = − 787.0 k J / m o l
S 2 + 2 O 2 → C O 2 + 2 S O 2
O 2 → C O 2 , Δ H f = − 393.5 k J / m o l S + O 2 → S O 2 , Δ H f = − 296.8 k J / m o l C + 2 S → C S 2 , Δ H f = 87.9 k J / m o l O 2 → C O 2 , Δ H f = − 393.5 k J / m o l
− 296.8 k J / m o l ] = − 593.6 k J / m o l
O 2 + 2 S + 2 O 2 + C S 2 → C O 2 + 2 S O 2 + C + 2 S ⇒ ⇒ Δ H = − 393.5 k J / m o l + 2 ⋅ ( − 296.8 k J / m o l ) + ( − 87.9 k J / m o l ) = − 1075.0 k J / m o l S 2 + 2 O 2 → C O 2 + 2 S O 2
H f ( p r o d u c t s ) − Σ Δ H f ( r e a c tan t s )
H ( r e a c t i o n ) = Δ H f ( C O 2 ) + 2 [ Δ H f ( S O 2 ) ] − Δ H f ( C S 2 ) − 2 [ Δ H f ( O 2 ) ]
H ( r e a c t i o n ) = − 393.5 k J / m o l + 2 ⋅ ( − 296.8 k J / m o l ) +( − 87.9 k J / m o l ) = − 1075.0 k J / m o l .

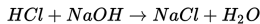
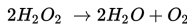
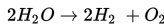
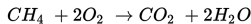
Hukum Hess merupakan akibat dari pernyataan hukum termodinamika yang pertama. Hal ini didasarkan pada kenyataan bahwa total energi di alam semesta tidak dapat diciptakan maupun dihancurkan.
Menurut hukum Hess, besarnya entalpi tidak bergantung pada tahap awal sampai akhir proses kimia. Dengan kata lain, hukum Hess menyatakan bahwa besarnya total perubahan entalpi selama terjadi reaksi adalah sama meskipun terdiri dari satu tahap atau terbagi menjadi beberapa tahapan.
Entalpi adalah kandungan panas suatu sistem yang dilambangkan dengan simbol H. Perubahan entalpi (ΔH) didefinisikan sebagai jumlah perbedaan entalpi antara reaktan dan produk reaksi. Perhitungan entalpi dapat dilakukan dengan melakukan beberapa langkah.
Panas pembentukan adalah panas yang dikeluarkan atau diperlukan saat terjadi pembentukan langsung 1 mol senyawa dari unsur-unsurnya. Panas pembentukan dilambangkan dengan ΔHf. Pada keadaan standar, entalpi suatu unsur adalah sebesar nol.
Aturan hukum Hess yang harus diperhatikan adalah:
1. Kalian dapat mengubah tanda entalpi untuk reaksi yang dibalik. Sebagai contoh, jika
Reaksi dengan arah maju adalah eksotermik (panas dikeluarkan) sedangkan reaksi dengan arah sebaliknya adalah endotermik.
2. Jika suatu reaksi dikalikan dengan sebuah konstanta, nilai ΔHf juga harus dikalikan dengan konstanta tersebut. Misalnya, apabila kalian ingin menghitung ΔHf dari dua mol CO2, maka kalian harus mengalikan:
3. Dua aturan sebelumnya dapat dikombinasikan.
Misalnya, jika saya ingin menghitung ΔH dari reaksi berikut ini:
maka saya dapat menggunakan persamaan berikut:
Apabila kita menerapkan aturan tersebut pada beberapa reaksi di atas, maka kita akan mendapatkan reaksi yang diinginkan.
gunakan persamaan ini karena kita memerlukan satu CO2 di bagian produk.
kita kalikan dengan dua karena kita memerlukan 2 SO2 di bagian produk.
ΔH = -87.9 kJ/mol karena kita telah menukar reaksi tersebut sebelumnya, sehingga tanda ΔH pun ikut berubah.
Kemudian, tambahkan reaksi-reaksi tersebut:
Sederhanakan reaksi tersebut. Tambahkan semuanya dan hilangkan zat kimia yang muncul sama di kedua sisi:
Akhirnya kita memiliki persamaan sendiri!
Cara lain menggunakan hukum Hess adalah dengan Panas Pembentukan, yang perhitungannya dilakukan sebagai berikut:
Mari kita lakukan lagi contoh sebelumnya dengan menggunakan persamaan di atas:
(ΔHfO2) bernilai nol karena O2 adalah sebuah unsur dalam keadaan standar. Selain itu, karbon padat, gas hidrogen, dan gas nitrogen juga mempunyai panas pembentukan nol. Kita menaruh koefisien 2 di depanΔHf(SO2) dan ΔHf(O2) karena itulah jumlah yang sebenarnya dalam reaksi tersebut.
S1
Manakah di antara prinsip berikut yang sesuai dengan hukum Hess Hess?
S2
Apa yang dimaksud dengan panas pembentukan?
S3
Manakah di antara pernyataan berikut yang SALAH?
S4
Jika terdapat reaksi reversibel (dua arah):

Nilai ΔHf adalah -393.5 kJ/mol secara langsung. Berapa nilai ΔHf secara tidak langsung?
S5
Jika nilai ΔHf(CO2)=-393,5kJ/mol. Berapakah nilai ΔHf dari 2 mol CO2?
S6
Apa yang harus diketahui untuk mencari perubahan entalpi (ΔH) dari reaksi berikut ini:
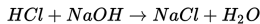
I. Laju reaksi
II. Panas pembentukan HCl
III. Panas pembentukan NaOH
IV. Panas pembentukan NaCl
V. Panas pembentukan H2O
VI. Temperatur ruangan awal dan akhir reaksi berlangsung.
S7
Berapakah perubahan entalpi pada reaksi berikut ini?
Jika ΔHf H2O=-285 kJ/mol dan ΔHf H2O2=-188 kJ/mol
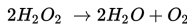
S8
Berapakah perubahan entalpi pada reaksi berikut ini? ΔHf H2O = -285 kJ/mol
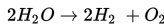
S9
Berapakah perubahan entalpi pada reaksi berikut ini?
ΔHf H2O = -285 kJ/mol
ΔHf CO2 = -394 kJ/mol
ΔHf CH4 = -75 kJ/mol
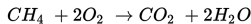
S10
Berapakan panas pembentukan O2 (ΔHf O2)?
