Contoh Soal Menentukan volume gas
Contoh Soal Menentukan volume gas - Pada topik sebelumnya, kalian sudah mempelajari salah satu hukum dasar kimia, yaitu hukum Dalton yang membahas mengenai hukum kelipatan berganda. Pada topik ini, kalian akan mempelajari hukum dasar kimia lainnya, yaitu hukum Gay Lussac yang dapat digunakan untuk menentukan volume gas.
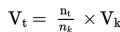
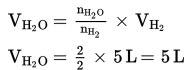
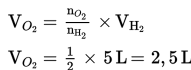
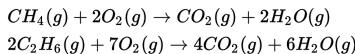
Sebelum kita membahas hukum Gay Lussac, mari kita ingat kembali mengenai hukum Dalton.
1. Hukum Dalton (Hukum Kelipatan Berganda)
Hukum Dalton atau yang dikenal dengan hukum kelipatan berganda berkaitan dengan pasangan unsur yang dapat membentuk lebih dari satu jenis senyawa. Sebagai contoh, pasangan unsur nitrogen dan oksigen yang dapat membentuk beberapa jenis senyawa nitrogen oksida, diantaranya nitrogen monoksida (NO) dan Nitrogen dioksida (NO2). Pada kasus tersebut, Dalton berpendapat bahwa jika massa dari salah satu unsur pada kedua senyawa tersebut sama, maka perbandingan massa unsur pada senyawa yang satu lagi merupakan perbandingan bilangan bulat yang sederhana.
Contoh penerapan Hukum Dalton
Jika pada senyawa nitrogen monoksida (NO) terdiri dari 14 g nitrogen dan 16 g oksigen, maka pada nitrogen dioksida (NO2) akan terdiri dari 14 g nitrogen dan 32 g oksigen. Perbandingan massa nitrogen dan oksigen pada senyawa nitrogen monoksida (NO) adalah 7 : 8. Sementara pada senyawa nitrogen dioksida (NO2), perbandingan massa nitrogen dan oksigennya adalah 7 : 16.
Jika pada senyawa nitrogen monoksida (NO) terdiri dari 14 g nitrogen dan 16 g oksigen, maka pada nitrogen dioksida (NO2) akan terdiri dari 14 g nitrogen dan 32 g oksigen. Perbandingan massa nitrogen dan oksigen pada senyawa nitrogen monoksida (NO) adalah 7 : 8. Sementara pada senyawa nitrogen dioksida (NO2), perbandingan massa nitrogen dan oksigennya adalah 7 : 16.
Bagaimana sudah ingat kembali? Jika sudah ingat kembali, mari kita lanjutkan pada materi cara menentukan volume gas.
2. Hukum Gay Lussac (Hukum Perbandingan Volume)
Hukum Gay Lussac berkaitan dengan perbandingan volume gas dalam sebuah persamaan reaksi kimia. Hukum ini dapat digunakan untuk menentukan volume gas dari sebuah pereaksi atau hasil reaksi. Hukum Gay Lussac lahir dari hasil sebuah eksperimen yang dilakukan oleh Gay Lussac sendiri dengan penemuannya sebagai berikut.
“Bila diukur pada suhu dan tekanan yang sama, perbandingan volume gas yang bereaksi dan gas hasil reaksi merupakan perbandingan bilangan bulat yang sederhana.”
Penemuan inilah yang kemudian dinamakan sebagai Hukum Gay Lussac.
Untuk menentukan volume gas pereaksi dan hasil reaksi dengan menggunakan Hukum Gay Lussac terdiri dari beberapa langkah, yaitu sebagai berikut.
a. Tulis dan setarakan persamaan reaksi kimianya.
b. Bandingkan koefisien senyawa yang ditanyakan volumenya dengan koefisien senyawa yang diketahui volumenya. Kemudian, kalikan dengan volume gas yang diketahui.
Secara matematis, dapat ditulis sebagai berikut.
“Bila diukur pada suhu dan tekanan yang sama, perbandingan volume gas yang bereaksi dan gas hasil reaksi merupakan perbandingan bilangan bulat yang sederhana.”
Penemuan inilah yang kemudian dinamakan sebagai Hukum Gay Lussac.
Untuk menentukan volume gas pereaksi dan hasil reaksi dengan menggunakan Hukum Gay Lussac terdiri dari beberapa langkah, yaitu sebagai berikut.
a. Tulis dan setarakan persamaan reaksi kimianya.
b. Bandingkan koefisien senyawa yang ditanyakan volumenya dengan koefisien senyawa yang diketahui volumenya. Kemudian, kalikan dengan volume gas yang diketahui.
Secara matematis, dapat ditulis sebagai berikut.
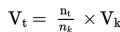
Dengan:
Vt = Volume gas yang ditanyakan;
Vk = Volume gas yang diketahui; dan
nt = Koefisien yang ditanyakan dan nk = Koefisien yang diketahui.
Vt = Volume gas yang ditanyakan;
Vk = Volume gas yang diketahui; dan
nt = Koefisien yang ditanyakan dan nk = Koefisien yang diketahui.
Mari kita pelajari penerapan hukum Gay Lussac pada penentuan volume gas seperti pada contoh berikut ini.
Contoh
Coba tentukan volume gas H2O dan O2 yang dihasilkan dari reaksi 5 liter gas H2 pada persamaan reaksi H2(g) + O2(g) → H2O(g).
Penyelesaian
Langkah-langkah penyelesaian:
a. Menuliskan persamaan reaksi: H2(g) + O2(g) → H2O(g).
b. Menyetarakan persamaan reaksi tersebut: 2H2(g) + O2(g) → 2H2O(g).
c. Menentukan perbandingan koefisien H2 : O2 : H2O = 2 : 1 : 2.
d. Menentukan volume gas yang ditanyakan, yaitu H2O dan O2.
Menentukan volume H2O
Contoh
Coba tentukan volume gas H2O dan O2 yang dihasilkan dari reaksi 5 liter gas H2 pada persamaan reaksi H2(g) + O2(g) → H2O(g).
Penyelesaian
Langkah-langkah penyelesaian:
a. Menuliskan persamaan reaksi: H2(g) + O2(g) → H2O(g).
b. Menyetarakan persamaan reaksi tersebut: 2H2(g) + O2(g) → 2H2O(g).
c. Menentukan perbandingan koefisien H2 : O2 : H2O = 2 : 1 : 2.
d. Menentukan volume gas yang ditanyakan, yaitu H2O dan O2.
Menentukan volume H2O
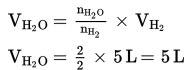
Menentukan volume O2
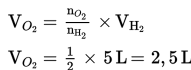
S1
Sebanyak 6 liter gas metana (CH4) mengalami reaksi pembakaran sempurna, menghasilkan gas karbondioksida (CO2) dan uap air (H 2O) sesuai persamaan reaksi CH4 (g) + O 2 (g) → CO 2 (g) + H 2O(g).
Jika diukur pada suhu dan tekanan yang sama, volume gas CO2 yang dihasilkan adalah …
Jika diukur pada suhu dan tekanan yang sama, volume gas CO2 yang dihasilkan adalah …
S2
Gas amoniak (NH3) dihasilkan dari reaksi gas nitrogen (N2) dengan gas hidrogen (H2) menurut persamaan reaksi N2 (g) + H2 (g) → NH3 (g).
Volume gas nitrogen dan hidrogen yang diperlukan untuk membuat 60 liter gas amoniak (diukur pada suhu dan tekanan yang sama) berturut-turut sebanyak …
Volume gas nitrogen dan hidrogen yang diperlukan untuk membuat 60 liter gas amoniak (diukur pada suhu dan tekanan yang sama) berturut-turut sebanyak …
S3
Pembakaran 12 liter gas sulfur dioksida (SO2) menghasilkan gas sulfur trioksida (SO3) sebanyak …
S4
Pembakaran tidak sempurna gas etena (C2H4) menghasilkan gas karbon monoksida (CO) dan uap air (H2O) menurut persamaan reaksi C2H4 (g) + O2(g) → CO(g) + H2O(g) (belum setara).
Jika diukur pada suhu dan tekanan yang sama dihasilkan CO sebanyak 200 mL. Volume gas oksigen yang diperlukan dalam reaksi tersebut sebanyak ….
Jika diukur pada suhu dan tekanan yang sama dihasilkan CO sebanyak 200 mL. Volume gas oksigen yang diperlukan dalam reaksi tersebut sebanyak ….
S5
Udara mengandung 20% gas oksigen. Pembakaran sempurna 8 liter gas etana (C2H6) dengan menggunakan oksigen dari udara akan menghasilkan karbondioksida dan uap air. Volume udara yang diperlukan dalam reaksi tersebut sebanyak ….
6
Gas asetilena (C2H2) dapat dibuat melalui reaksi pembakaran gas metana (CH2 sesuai reaksi di bawah ini).
CH4(g) + O2(g) → C2H2(g) + H2O(g) (belum setara) …. reaksi tahap 1
CH4(g) + O2(g) → C2H2(g) + H2O(g) (belum setara) …. reaksi tahap 1
Pada tahap selanjutnya, gas asetilena (C2H2) yang dihasilkan dari pembakaran metana tersebut, direaksikan dengan oksigen sehingga menghasilkan karbondioksida dan air sesuai persamaan reaksi berikut.
C2H2(g) + O2(g) → CO2(g) + H2O(g) (belum setara)…. reaksi tahap 2
C2H2(g) + O2(g) → CO2(g) + H2O(g) (belum setara)…. reaksi tahap 2
Jika gas metana yang digunakan pada reaksi tahap 1 sebanyak 8 liter, gas karbondioksida yang dihasilkan pada reaksi tahap 2 sebanyak ….
S7
Pada pembakaran sempurna 20 liter campuran gas metana (CH4) dan gas etana (C2H6) dihasilkan 24 liter gas karbondioksida (CO2) menurut persamaan berikut ini.
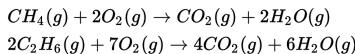
Jika diukur pada suhu dan tekanan yang sama, volume dari penyusun campuran tersebut adalah ….
S8
Sebanyak 20 mL suatu gas nitrogen oksida yang belum diketahui rumus molekulnya (NxOy) diuraikan menjadi 20 mL nitrogen dan 30 mL oksigen. Jika pengukuran volume tersebut dilakukan pada suhu yang sama, maka rumus molekul dari nitrogen oksida tersebut adalah ….
S9
Karbondioksida dapat dihasilkan dari reaksi antara karbonmonoksida (CO) dan oksigen (O2) menurut persamaan reaksi CO(g) + O2(g) → CO2(g).
Jika karbondioksida yang terbentuk sebanyak 5 liter, maka volume oksigen yang terlibat dalam reaksi tersebut adalah … (diukur pada suhu dan tekanan yang sama
Jika karbondioksida yang terbentuk sebanyak 5 liter, maka volume oksigen yang terlibat dalam reaksi tersebut adalah … (diukur pada suhu dan tekanan yang sama
S10
Sebanyak 6 liter uap air dihasilkan dari reaksi antara gas hidrogen dan gas oksigen menurut persamaan reaksi H2(g) + O2(g) → H2O(g).
Volume gas hidrogen dan oksigen yang terllbat dalam reaksi tersebut jika pengukuran dilakukan pada suhu dan tekanan yang sama adalah ….
Volume gas hidrogen dan oksigen yang terllbat dalam reaksi tersebut jika pengukuran dilakukan pada suhu dan tekanan yang sama adalah ….
