Contoh Soal Hukum Avogadro
Contoh Soal Hukum Avogadro - Pada topik sebelumnya, kalian sudah mempelajari hukum Gay Lussac atau yang dikenal dengan hukum perbandingan volume. Pada topik ini, kalian akan mempelajari hukum Avogadro yang merupakan penjelasan lanjutan dari hukum Gay Lussac.
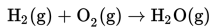

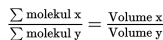
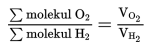
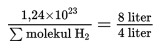
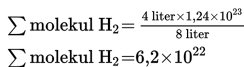
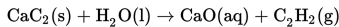
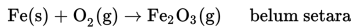
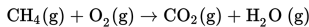
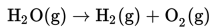
Mari ingat kembali mengenai hukum Gay Lussac dalam penentuan volume suatu gas pada persamaan reaksi kimia.
1. Hukum Gay Lussac (Hukum Perbandingan Volume)
Hukum Gay Lussac atau hukum perbandingan volume digunakan untuk menentukan volume dari suatu gas dalam persamaan reaksi kimia. Hukum Gay Lussac ini berbunyi : “Bila diukur pada suhu dan tekanan yang sama, perbandingan volume gas yang bereaksi dan hasil reaksi merupakan bilangan bulat yang sederhana”. Secara sederhananya dapat dikatakan bahwa untuk menentukan volume suatu gas dalam suatu reaksi kimia dapat dilakukan dengan cara membandingkan koefisien pada masing-masing zat yang bertindak sebagai pereaksi atau hasil reaksi.
Contoh penerapan hukum Gay Lussac
Tentukan volume gas H2O yang dihasilkan dari reaksi 5 liter gas H2 pada persamaan reaksi berikut
Contoh penerapan hukum Gay Lussac
Tentukan volume gas H2O yang dihasilkan dari reaksi 5 liter gas H2 pada persamaan reaksi berikut
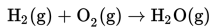
Langkah-langkah penyelesaiannya sebagai berikut.
Menuliskan persamaan reaksi : H2(g) + O2(g) → H2O(g).
Menyetarakan persamaan reaksi tersebut: 2H2 (g) + O2(g) → 2H2O(g).
Menentukan perbandingan koefisien H2 : O2 : H2O = 2 : 1 : 2.
Menentukan volume gas yang ditanyakan (H2O dan O2).
Menuliskan persamaan reaksi : H2(g) + O2(g) → H2O(g).
Menyetarakan persamaan reaksi tersebut: 2H2 (g) + O2(g) → 2H2O(g).
Menentukan perbandingan koefisien H2 : O2 : H2O = 2 : 1 : 2.
Menentukan volume gas yang ditanyakan (H2O dan O2).

Cara di atas, merupakan cara efektif untuk menentukan jumlah molekul maupun volume zat.
2. Hukum Avogadro
Hukum Avogadro ini merupakan penjelasan lanjutan untuk memperjelas apa yang dikemukan oleh Gay Lussac mengenai hukum perbandingan volume. Dalam menjelaskan hukum Gay Lussac, Avogadro mengajukan sebuah hipotesis : “Pada suhu dan tekanan yang sama, semua gas yang volumenya sama mengandung jumlah partikel yang sama.” Berdasarkan hipotesis ini maka diperoleh hukum Avogadro yaitu : “Pada suhu dan tekanan yang sama, perbandingan volume gas sesuai dengan perbandingan jumlah partikelnya.”. Hukum Avogadro ini dapat dituliskan dalam persamaan berikut ini :
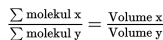
Selain menjelaskan hubungan antara jumlah molekul dan volume, hukum Avogadro juga dapat menjelaskan hubungan antara jumlah molekul, volume dan koefisien reaksi. Hubungan tersebut menjelaskan bahwa “Pada suhu dan tekanan yang sama, perbandingan volume gas sesuai dengan perbandingan jumlah molekul dan sesuai dengan perbandingan koefisien reaksinya”.
Mari kita lihat penerapan hukum Avogadro ini dalam soal berikut ini :
Contoh soal :
8 Liter gas gas oksigen (O2) mengandung 1,24x1023 molekul oksigen. Jika diukur pada suhu dan tekanan yang sama, berapakah jumlah molekul yang terkadung dalam 4 liter gas hidrogen (H2)?
8 Liter gas gas oksigen (O2) mengandung 1,24x1023 molekul oksigen. Jika diukur pada suhu dan tekanan yang sama, berapakah jumlah molekul yang terkadung dalam 4 liter gas hidrogen (H2)?
Langkah-langkah penyelesaian:
a. menentukan komponen-komponen yang diketahui, dalam soal ini 8 Liter gas oksigen O2 yang mengandung 1,24x1023molekul ;
b. menentukan komponen yang ditanyakan, dalam soal ini jumlah molekul H2 yang terdapat dalam 4 liter gas hidrogen jika diukur pada suhu dan tekanan yang sama;
c. memasukan komponen-komponen tersebut ke dalam persamaan
a. menentukan komponen-komponen yang diketahui, dalam soal ini 8 Liter gas oksigen O2 yang mengandung 1,24x1023molekul ;
b. menentukan komponen yang ditanyakan, dalam soal ini jumlah molekul H2 yang terdapat dalam 4 liter gas hidrogen jika diukur pada suhu dan tekanan yang sama;
c. memasukan komponen-komponen tersebut ke dalam persamaan
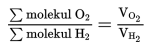
d. memasukan angka-angka ke dalam persamaan tersebut; dan
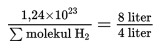
e. menghitung jumlah molekul gas hidrogen H2 dari persamaan tersebut.
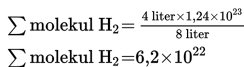
Jadi jumlah molekul H2 dalam 4 liter gas hidrogen adalah 6,2x1022 molekul.
S1
4,2 liter gas metana (CH4) mengandung 4,5x1023 molekul. Pada suhu dan tekanan yang sama, terdapat gas amoniak (NH3) sebanyak 6x1023 molekul. Volume gas amoniak pada kondisi tersebut adalah....
S2
Pada 4 ml CO2 terdapat 3,01x1023 molekul. Pada kondisi yang sama, dilakukan pengukuran terhadap jumlah molekul 10 ml N2. Jumlah molekul N2 pada kondisi tersebut adalah….
S3
Gas etuna (C2H2) dihasilkan dari reaksi antara kalsium karbida dengan air berdasarkan reaksi berikut :
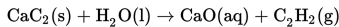
Jumlah gas etuna pada reaksi tersebut adalah 1,3x1023 molekul. Untuk menentukan volumenya, dilakukan pengukuran pada kondisi yang sama menggunakan 52 ml O2 sebanyak 2,6x1023 molekul. Volume gas etuna yang dihasilkan pada reaksi tersebut adalah….
4
31x1023 molekul amonia dapat ditampung pada wadah berukuran 108 liter. Jika kondisi tersebut digunakan untuk mengukur 7,75x1023 molekul gas ozon, maka volume ozon pada kondisi tersebut adalah….
S5
Dalam suatu wadah bervolume 5 liter terdapat gas hidrogen (H2) yang mengandung 6x1022 molekul. Pada kondisi yang sama dilakukan pengukuran terhadap 10 liter gas oksigen (O2). Jumlah molekul oksigen pada hasil pengukuran tersebut adalah….
S6
Pembakaran 6,4x1023 atom besi menghasilkan Fe2O3 sesuai persamaan reaksi berikut.
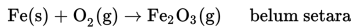
Jumlah molekul Fe2O3 yang terbentuk pada reaksi tersebut jika diukur pada suhu dan tekanan yang sama adalah…
S7
Pembakaran 16 liter gas metana (CH4) yang mengandung 1,204x1024 molekul menghasilkan karbondioksida dan uap air sesuai persamaan berikut.
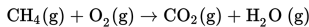
Jika diukur pada suhu dan tekanan yang sama, jumlah molekul CO2 yang dihasilkan dari reaksi tersebut adalah….
S8
Reaksi penguraian 3,2x1021 molekul H2O menghasilkan hidrogen dan oksigen sesuai persamaan reaksi berikut.
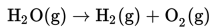
Jumlah molekul oksigen yang dihasilkan dari reaksi tersebut adalah….
S9
Dalam sekali produksi, suatu pabrik mampu menghasilkan 2,15x1023 molekul gas metana (CH4) yang bervolume 250 liter. Kondisi tersebut juga dimanfaatkan untuk menghasilkan 3,45x1024 molekul gas amonia (NH3). Volume amonia yang dihasilkan untuk sekali produksi adalah....
S10
Sebanyak 45 liter gas karbondioksida mengandung 2,5x1023 molekul. Gas tersebut dihasilkan dari reaksi antara karbonmonoksida dan oksigen. Jumlah molekul yang terkandung dalam 15 liter karbonmonoksida pada reaksi tersebut adalah….
