Contoh Soal Menentukan jumlah partikel zat
Contoh Soal Menentukan jumlah partikel zat - Hukum Avogadro menyatakan bahwa: “Pada suhu dan tekanan yang sama, perbandingan volume gas sesuai dengan perbandingan jumlah partikelnya.” Persamaannya dapat dituliskan sebagai berikut.
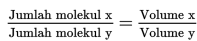
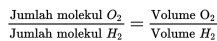
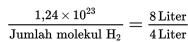
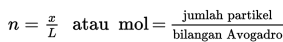
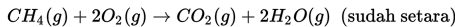
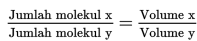
Contoh penerapan hukum Avogadro:
8 Liter gas oksigen (O2) mengandung 1.24 x 1023 molekul oksigen. Jika diukur pada suhu dan tekanan yang sama, berapakah jumlah molekul yang terkandung dalam 4 Liter gas hidrogen (H2)?
Penyelesaian:
8 Liter gas oksigen (O2) mengandung 1.24 x 1023 molekul oksigen. Jika diukur pada suhu dan tekanan yang sama, berapakah jumlah molekul yang terkandung dalam 4 Liter gas hidrogen (H2)?
Penyelesaian:
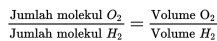
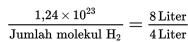
Jumlah molekul H2 = 0,62 x 1023 = 6,2 x 1022
Jadi, jumlah molekul H2 dalam 4 Liter gas hidrogen adalah 6,2 x 1022 molekul.
Bagaimana sudah ingat kembali? Mari kita lanjutkan ke topik selanjutnya tentang cara menentukan partikel zat.
Jadi, jumlah molekul H2 dalam 4 Liter gas hidrogen adalah 6,2 x 1022 molekul.
Bagaimana sudah ingat kembali? Mari kita lanjutkan ke topik selanjutnya tentang cara menentukan partikel zat.
2. MENENTUKAN JUMLAH PARTIKEL ZAT
Untuk menentukan jumlah partikel yang terkandung dalam suatu zat digunakan bilangan Avogadro. Bilangan ini disimbolkan dengan “L”. Nama Avogadro sendiri diberikan sebagai bentuk penghormatan kepada seorang ilmuwan Italia bernama Amadeo Avogadro. Avogadro adalah orang yang pertama kali mengusulkan perlunya satuan jumlah partikel. Sementara itu simbol “L” merupakan penghomatan kepada orang yang pertama kali menghitung jumlah partikel suatu zat, yaitu J.Loschmidt.
Bilangan Avogadro ini memiliki nilai L = 6.02 x 1023.
Pada hasil perhitungannya dihasilkan 1 mol zat = 6.02 x 1023. Dengan kata lain, 1 mol zat mengandung 6.02 x 1023 jumlah partikel. Berdasarkan hubungan mol dan jumlah partikel ini, maka diperoleh persamaan sebagai berikut.
Untuk menentukan jumlah partikel yang terkandung dalam suatu zat digunakan bilangan Avogadro. Bilangan ini disimbolkan dengan “L”. Nama Avogadro sendiri diberikan sebagai bentuk penghormatan kepada seorang ilmuwan Italia bernama Amadeo Avogadro. Avogadro adalah orang yang pertama kali mengusulkan perlunya satuan jumlah partikel. Sementara itu simbol “L” merupakan penghomatan kepada orang yang pertama kali menghitung jumlah partikel suatu zat, yaitu J.Loschmidt.
Bilangan Avogadro ini memiliki nilai L = 6.02 x 1023.
Pada hasil perhitungannya dihasilkan 1 mol zat = 6.02 x 1023. Dengan kata lain, 1 mol zat mengandung 6.02 x 1023 jumlah partikel. Berdasarkan hubungan mol dan jumlah partikel ini, maka diperoleh persamaan sebagai berikut.
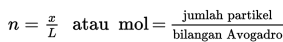
Jadi, untuk menentukan jumlah partikel dapat digunakan persamaan berikut.
x = nL atau Jumlah partikel = mol x bilangan avogadro
x = nL atau Jumlah partikel = mol x bilangan avogadro
Contoh soal:
Coba tentukan jumlah partikel yang terkandung dalam 5 mol besi.
Coba tentukan jumlah partikel yang terkandung dalam 5 mol besi.
Penyelesaian:
Menentukan komponen yang diketahui dan ditanyakan:
Diketahui 5 mol besi
Ditanyakan jumlah partikel yang terkandung dalam besi tersebut.
Menentukan komponen yang diketahui dan ditanyakan:
Diketahui 5 mol besi
Ditanyakan jumlah partikel yang terkandung dalam besi tersebut.
Memasukkan komponen tersebut ke dalam persamaan dan menentukan jumlah partikel besi:
x = nL
x = nL
= 5 mol x 6,02 x 1023
= 30,1 x 1023 = 3,01 x 1024
Jadi, jumlah partikel besi yang terkandung dalam 5 mol besi adalah 3,01 x 1024 atom besi.
Catatan: Partikel penyusun zat bisa berupa atom, molekul, atau ion.
= 30,1 x 1023 = 3,01 x 1024
Jadi, jumlah partikel besi yang terkandung dalam 5 mol besi adalah 3,01 x 1024 atom besi.
Catatan: Partikel penyusun zat bisa berupa atom, molekul, atau ion.
S1
Jumlah partikel yang terkandung dalam 0.25 mol O2 sebanyak ….
S2
Sebongkah logam seng (Zn) memiliki mol sebesar 7.5 mol. Jumlah partikel yang terkandung dalam logam seng tersebut sebanyak ….
S3
Dalam suatu larutan elektrolit terdapat 0,02 mol ion Ca2+. Jumlah partikel Ca2+ dalam larutan tersebut sebanyak …
S4
Sebatang besi tersusun atas 7,525 x 1022 atom Fe. Jumlah mol yang terdapat dalam besi tersebut ada …
S5
Penguraian CaCO3 menghasilkan CaO dan CO2. Pada reaksi penguraian tersebut dihasilkan 0,05 mol CO2. Jumlah molekul CO2 yang dihasilkan dari reaksi penguraian tersebut ada ….
S6
Pada suatu larutan terdapat 2 mol MgCl2. Jumlah ion Cl- yang terdapat dalam larutan tersebut ada ….
S7
Pembakaran 24.08 x 1023 molekul metana menghasilkan karbondioksida dan uap air sesuai persamaan reaksi berikut.
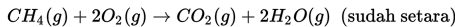
Jumlah mol H2O yang dihasilkan dari reaksi pembakaran metana tersebut ada ….
S8
1 mol NH3 dihasilkan dari reaksi antara N2 dan H2. Jumlah molekul N2 yang diperlukan untuk menghasilkan 1 mol NH3 tersebut ada ….
S9
Logam alumunium (Al) dihasilkan dari penguraian Al2O3 sesuai reaksi berikut ini.
2Al2O3 → 4Al + 3O2 (sudah setara)
Jika 2,7 mol Al2O3 terurai sesuai reaksi tersebut, jumlah atom Al yang dihasilkan ada ….
S10
Pada suatu larutan terdapat 8,12 x 1023 ion Br- yang dihasilkan dari pelarutan BaBr2. Jumlah mol BaBr2 yang dilarutkan pada sistem tersebut ada ….
