Contoh Soal Eter
Contoh Soal Eter - Eter (alkoksialkana) merupakan senyawa turunan alkana dengan 2 alkil mengapit atom O. Struktur eter dapat dituliskan sebagai R-O-R dengan R dapat berupa alkil maupun aril (benzena yang kehilangan satu atom H). Rumus umum eter sama dengan alkohol yaitu CnH2n + 2O. Eter memiliki ikatan C-O-C dengan sudut ikatan ± 110⁰ dan jarak C-O ± 140 pm.
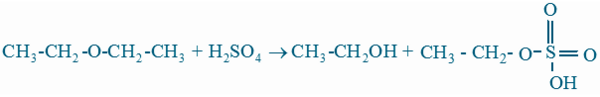
Contoh:
{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{ - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - O - C}}{{\rm{H}}_{\rm{3}}}
Senyawa di atas adalah eter dengan nama metoksi etana atau etil metil eter.
{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{ - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - O - C}}{{\rm{H}}_{\rm{3}}}
Senyawa di atas adalah eter dengan nama metoksi etana atau etil metil eter.
Sifat-Sifat Eter
A. Sifat Fisik
1. Senyawa eter rantai pendek berwujud cair pada suhu kamar dan larut dalam air. Eter rantai panjang sulit larut dalam air dan larut dalam pelarut organik.
2. Titik didih eter meningkat seiring dengan meningkatnya massa molekul. Pada jumlah atom C yang sama, titik didih eter lebih tinggi dari alkana dan lebih rendah dari alkohol. Hal ini disebabkan eter memiliki kepolaran rendah.
3. Eter merupakan pelarut yang baik untuk senyawa yang tidak mudah larut dalam air seperti lemak, minyak, resin, alkaloid, brom, dan yodium.
4. Eter umumnya adalah cairan yang tidak berwarna, mudah menguap, berbau khas, dan mudah terbakar.
5. Eter tidak dapat membentuk ikatan hidrogen antara molekul-molekulnya karena tidak ada atom hidrogen yang terikat pada oksigen. Namun, eter dapat membentuk ikatan hidrogen dengan air jika dilarutkan ke dalamnya. Semakin panjang rantai alkilnya, kelarutan eter semakin berkurang di dalam air.
1. Senyawa eter rantai pendek berwujud cair pada suhu kamar dan larut dalam air. Eter rantai panjang sulit larut dalam air dan larut dalam pelarut organik.
2. Titik didih eter meningkat seiring dengan meningkatnya massa molekul. Pada jumlah atom C yang sama, titik didih eter lebih tinggi dari alkana dan lebih rendah dari alkohol. Hal ini disebabkan eter memiliki kepolaran rendah.
3. Eter merupakan pelarut yang baik untuk senyawa yang tidak mudah larut dalam air seperti lemak, minyak, resin, alkaloid, brom, dan yodium.
4. Eter umumnya adalah cairan yang tidak berwarna, mudah menguap, berbau khas, dan mudah terbakar.
5. Eter tidak dapat membentuk ikatan hidrogen antara molekul-molekulnya karena tidak ada atom hidrogen yang terikat pada oksigen. Namun, eter dapat membentuk ikatan hidrogen dengan air jika dilarutkan ke dalamnya. Semakin panjang rantai alkilnya, kelarutan eter semakin berkurang di dalam air.
B. Sifat Kimia
Secara umum, eter bersifat inert seperti alkana, tidak bereaksi dengan oksidator, reduktor, dan basa, kecuali pada suhu tinggi. Sifat inilah yang menyebabkan eter banyak digunakan sebagai pelarut organik.
Secara umum, eter bersifat inert seperti alkana, tidak bereaksi dengan oksidator, reduktor, dan basa, kecuali pada suhu tinggi. Sifat inilah yang menyebabkan eter banyak digunakan sebagai pelarut organik.
Reaksi kimia eter adalah sebagai berikut.
1. Hidrolisis
Hidrolisis eter dengan asam sulfat menghasilkan alkohol. Secara umum, reaksinya adalah
{\rm{R - O - R \,\, + \,\, }}{{\rm{H}}_{\rm{2}}}{\rm{O }} \xrightarrow{\rm{H_2SO_4}} {\rm{2R - OH}}
1. Hidrolisis
Hidrolisis eter dengan asam sulfat menghasilkan alkohol. Secara umum, reaksinya adalah
{\rm{R - O - R \,\, + \,\, }}{{\rm{H}}_{\rm{2}}}{\rm{O }} \xrightarrow{\rm{H_2SO_4}} {\rm{2R - OH}}
2. Halogenasi
Eter dapat mengalami reaksi substitusi oleh halogen.
Contoh:
{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{ - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - O - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - C}}{{\rm{H}}_{\rm{3}}}{\rm{ \,\, + \,\, C}}{{\rm{l}}_{\rm{2}}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{ - CH(Cl) - O - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - C}}{{\rm{H}}_{\rm{3}}}{\rm{ \,\, + \,\, HCl}}
Eter dapat mengalami reaksi substitusi oleh halogen.
Contoh:
{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{ - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - O - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - C}}{{\rm{H}}_{\rm{3}}}{\rm{ \,\, + \,\, C}}{{\rm{l}}_{\rm{2}}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{ - CH(Cl) - O - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - C}}{{\rm{H}}_{\rm{3}}}{\rm{ \,\, + \,\, HCl}}
3. Reaksi dengan Asam Sulfat
Eter dapat bereaksi dengan asam sulfat menghasilkan alkohol dan asam alkana sulfonat.
Eter dapat bereaksi dengan asam sulfat menghasilkan alkohol dan asam alkana sulfonat.
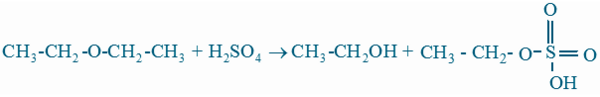
4. Reaksi dengan Asam Halida
Eter terurai oleh asam halida, terutama asam iodida (HI).
Jika asam halida terbatas:
{\rm{R - O - R' \,\, + \,\, HI}} \to {\rm{R - OH \,\, + \,\, R' - I}}
Jika asam halida berlebihan:
{\rm{R - O - R' \,\, + \,\, 2HI}} \to {\rm{R – I \,\, + \,\, R' – I \,\, + \,\, H_2O}}
Eter terurai oleh asam halida, terutama asam iodida (HI).
Jika asam halida terbatas:
{\rm{R - O - R' \,\, + \,\, HI}} \to {\rm{R - OH \,\, + \,\, R' - I}}
Jika asam halida berlebihan:
{\rm{R - O - R' \,\, + \,\, 2HI}} \to {\rm{R – I \,\, + \,\, R' – I \,\, + \,\, H_2O}}
5. Reaksi dengan PCl5
Eter dapat bereaksi dengan PCl5, tetapi tidak menghasilkan HCl.
Eter dapat bereaksi dengan PCl5, tetapi tidak menghasilkan HCl.
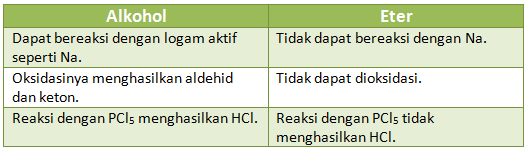
Perbedaan sifat kimia antara alkohol dan eter disajikan dalam tabel berikut.

Kegunaan dan Pembuatan Eter
A. Kegunaan Eter
1. Sebagai pelarut karena dapat melarutkan banyak senyawa organik yang tidak larut dalam air.
2. Sebagai obat bius pada operasi misalnya dietil eter dan vinil eter.
3. Sebagai bahan tambahan (zat aditif) pada bahan bakar untuk menaikkan bilangan oktan bensin, yaitu metil tersier-butil eter (MTBE).
4. Dimetil eter (DME) sebagai aerosol propellant oleh industri kosmetik dan kesehatan, tenaga pembangkit untuk gas turbin, bahan bakar untuk memasak, bahan bakar mesin diesel, dan sumber hidrogen untuk bahan bakar kendaraan
1. Sebagai pelarut karena dapat melarutkan banyak senyawa organik yang tidak larut dalam air.
2. Sebagai obat bius pada operasi misalnya dietil eter dan vinil eter.
3. Sebagai bahan tambahan (zat aditif) pada bahan bakar untuk menaikkan bilangan oktan bensin, yaitu metil tersier-butil eter (MTBE).
4. Dimetil eter (DME) sebagai aerosol propellant oleh industri kosmetik dan kesehatan, tenaga pembangkit untuk gas turbin, bahan bakar untuk memasak, bahan bakar mesin diesel, dan sumber hidrogen untuk bahan bakar kendaraan
B. Pembuatan Eter
1. Mereaksikan Alkohol dengan Asam Sulfat pada Suhu 140⁰C
Contohnya adalah reaksi antara etanol dan asam sulfat pada suhu 140⁰C yang menghasilkan dietil eter dan air.
{\rm{2C}}{{\rm{H}}_3}{\rm{C}}{{\rm{H}}_2}{\rm{OH \,\, + \,\, }}{{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} \,\, \to \,\, {\rm{C}}{{\rm{H}}_3}{\rm{C}}{{\rm{H}}_2}{\rm{OC}}{{\rm{H}}_2}{\rm{C}}{{\rm{H}}_3}{\rm{ \,\, + \,\, }}{{\rm{H}}_2}{\rm{O}}
1. Mereaksikan Alkohol dengan Asam Sulfat pada Suhu 140⁰C
Contohnya adalah reaksi antara etanol dan asam sulfat pada suhu 140⁰C yang menghasilkan dietil eter dan air.
{\rm{2C}}{{\rm{H}}_3}{\rm{C}}{{\rm{H}}_2}{\rm{OH \,\, + \,\, }}{{\rm{H}}_2}{\rm{S}}{{\rm{O}}_4} \,\, \to \,\, {\rm{C}}{{\rm{H}}_3}{\rm{C}}{{\rm{H}}_2}{\rm{OC}}{{\rm{H}}_2}{\rm{C}}{{\rm{H}}_3}{\rm{ \,\, + \,\, }}{{\rm{H}}_2}{\rm{O}}
2. Sintesis Williamson
Pembuatan eter dengan sintesis ini melalui dua tahap yaitu sebagai berikut.
Pembuatan eter dengan sintesis ini melalui dua tahap yaitu sebagai berikut.
- Tahap pertama adalah mengkonversi alkohol menjadi alkoksidanya melalui pengolahan dengan logam reaktif (natrium atau kalium). Reaksinya:
2{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{OH \,\, + \,\, 2Na}} \to {\rm{2}}{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{ONa \,\, + \,\, }}{{\rm{H}}_{\rm{2}}} - Tahap selanjutnya adalah mereaksikan alkoksida dengan alkil halida. Reaksinya:
{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{ONa \,\, + \,\, C}}{{\rm{H}}_{\rm{3}}}{\rm{Br}} \to {{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{-O-C}}{{\rm{H}}_{\rm{3}}}{\rm{ \,\, + \,\, NaBr}}
2. Mereaksikan Alkil Halida dengan Perak (I) Oksida
Reaksi alkil halida dengan perak (I) oksida menghasilkan eter dan perak klorida. Contoh:
{\rm{2C}}{{\rm{H}}_{\rm{3}}}{\rm{ - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - Cl \,\, + \,\, A}}{{\rm{g}}_{\rm{2}}}{\rm{O}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{ - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - O - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - C}}{{\rm{H}}_{\rm{3}}}{\rm{ \,\, + \,\, 2AgCl}}
Reaksi alkil halida dengan perak (I) oksida menghasilkan eter dan perak klorida. Contoh:
{\rm{2C}}{{\rm{H}}_{\rm{3}}}{\rm{ - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - Cl \,\, + \,\, A}}{{\rm{g}}_{\rm{2}}}{\rm{O}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{ - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - O - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - C}}{{\rm{H}}_{\rm{3}}}{\rm{ \,\, + \,\, 2AgCl}}
S1
Titik didih eter lebih rendah dibanding alkohol dengan jumlah atom C yang sama. Hal ini karena .…
S2
Pernyataan yang benar tentang kelarutan senyawa berikut dalam air adalah .…
S3
Hidrolisis eter umumnya menggunakan asam sulfat encer. Reaksi ini menghasilkan senyawa dengan rumus umum ....
S4
Pembuatan eter dengan sintesis Williamson terdiri dari 2 tahap. Senyawa yang dihasilkan pada tahap pertama adalah ....
S5
Senyawa eter yang digunakan sebagai obat bius dan zat aditif pada bensin berturut-turut adalah .…
S6
Senyawa dengan rumus umum CnH2n + 2O dan dapat bereaksi dengan logam natrium menghasilkan natrium etoksida adalah .…
S7
Perhatikan reaksi substitusi berikut.
{\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{ - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - O - C}}{{\rm{H}}_{\rm{2}}}{\rm{ - C}}{{\rm{H}}_{\rm{3}}}{\rm{ \,\, + \,\, C}}{{\rm{l}}_{\rm{2}}} \to {\rm{produk}}
Salah satu produk yang dihasilkan pada reaksi tersebut adalah ....
S8
Salah satu persamaan antara eter dan alkohol adalah ...
S9
Eter dapat membentuk ikatan hidrogen antarmolekul jika dicampurkan dengan ....
S10
Salah satu reaksi pembuatan eter adalah sebagai berikut.
{{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{5}}}{\rm{ONa \,\, + \,\, C}}{{\rm{H}}_{\rm{3}}}{\rm{Br}} \to {\rm{A \,\, + \,\, NaBr}}
Senyawa A yang dihasilkan adalah ....
