Contoh Soal Sifat Fisis dan Kimia Unsur Gas Mulia
Contoh Soal Sifat Fisis dan Kimia Unsur Gas Mulia - Gas mulia dalam sistem periodik terdapat dalam golongan VIIIA. Gas mulia dahulu juga disebut golongan nol. Gas mulia terdiri atas unsur-unsur helium (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe), dan radon (Rn). Radon bersifat radioaktif.
 Titik cair dan titik didih
Titik cair dan titik didih
Gas mulia merupakan gas monoatomik, tidak berwarna, tidak berasa, dan tidak berbau. Argon, kripton, dan xenon sedikit larut dalam air akibat terjebak di antara molekul air. Helium dan neon tidak dapat larut dalam air, sebab jari-jari atomnya terlalu kecil sehingga dapat meninggalkan air.
Sifat-sifat fisis
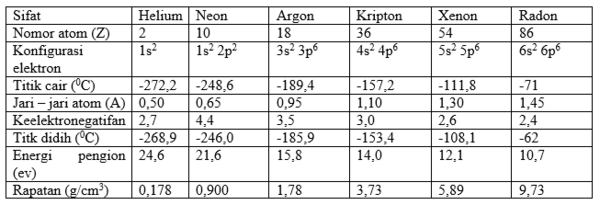
Coba perhatikan sifat fisis gas mulia yang berubah secara periodik, seperti terlihat pada tabel di bawah ini.

Titik cair dan titik didih gas mulia meningkat dengan bertambahnya nomor atom. Hal ini disebabkan semakin bertambahnya gaya dispersi antar atom gas mulia sesuai bertambahnya massa atom relatif (Ar).
Kelarutan
Kelarutan gas mulia dalam air bertambah besar dari Helium (He) hingga Radon (Rn). Pada suhu 0 °C dalam 100 ml air terlarut 1 ml He, 6 ml Ar, dan 50 ml Rn.
Wujud gas mulia
Unsur gas mulia terdapat sebagai gas tak berwarna yang monoatomik, ini erat kaitannya dengan struktur elektron oktet dan duplet dari gas mulia sedangkan wujud gas pada suhu kamar disebabkan titik cair dan titik didih gas mulia yang rendah.
Sifat kimia
Selama bertahun-tahun unsur gas mulia disebut sebagai gas inert (tidak mudah bereaksi). Sejak penemuan {\rm{XePtF}}_6 (Xenon Hexaflouro Platinat) oleh Neil Bartlett anggapan gas inert gugur. Energi ionisasi kripton, xenon dan radon hampir sama dengan energi ionisasi oksigen dan masih lebih rendah dari fluor. Oleh karena itu dimungkinkan tiga unsur tersebut dapat membentuk senyawa dan telah dibuktikan oleh Bartlett. Radon dapat bereaksi spontan dengan fluor pada suhu kamar. Sementara xenon memerlukan pemanasan atau permulaan reaksi secara fotokimia. Xenon dapat bereaksi dengan fluor pada suhu 400 °C dan tekanan 6 atmosfer.
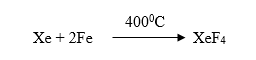
Kripton bereaksi dengan fluor hanya bila keduanya dikenakan penyinaran atau pelepasan muatan listrik.
Kereaktifan gas mulia bertambah besar sesuai pertambahan jari – jari atomnya, yaitu dari atas ke bawah. Pertambahan jari – jari atom mengakibatkan daya tarik inti terhadap elektron kulit luar berkurang, sehingga elektronnya semakin mudah ditarik oleh atom lain. Walaupun senyawa gas mulia telah berhasil dibuat, namun tetap harus diakui bahwa unsur gas mulia lebih stabil dari semua golongan lainnya. Unsur gas mulia hanya dapat berikatan dengan unsur yang sangat elektronegatif, seperti fluorin dan oksigen.
Setelah senyawa gas mulia berhasil dibuat, istilah gas inert (lemban) tidak sesuai lagi. Para ahli lebih cenderung menggunakan istilah gas mulia, yang berarti stabil atau sukar bereaksi, serupa dengan istilah logam mulia yang digunakan untuk emas dan platina.
S1
Berikut ini sifat gas mulia yang makin berkurang dengan bertambahnya massa atom adalah ....
S2
Titik leleh gas mulia hanya berbeda beberapa derajat di bawah titik didihnya karena ....
S3
Unsur gas mulia sukar bereaksi dengan unsur lain. Hal ini disebabkan ....
S4
Gas mulia yang dapat disintesis membentuk senyawa dengan unsur lain adalah ....
S5
Gas mulia mempunyai konfigurasi elektron paling stabil. Pernyataan berikut yang tidak sesuai dengan keadaan gas tersebut adalah ....
S6
Alasan Helium dan neon tidak dapat larut dalam air karena ....
S7
Hal yang menyebabkan titik cair dan titik didih gas mulia meningkat seiring dengan bertambahnya nomor atom adalah ....
S8
Hal yang menyebabkan semua unsur – unsur golongan gas mulia berwujud gas pada suhu kamar adalah ....
S9
Dari 7 unsur yang terdapat di golongan gas mulia hanya tiga unsur yang dimungkinkan dapat membentuk senyawa. Hal apa yang menjadi penyebabnya adalah ....
S10
Hal yang terjadi akibat pertambahan jari – jari atom dari atas ke bawah adalah ....
