Contoh Soal Menentukan orde reaksi
Contoh Soal Menentukan orde reaksi - Dalam pertemuan ini, kita akan membahas tentang penentuan orde reaksi. Sebelumnya kalian pasti telah mempelajari tentang pengertian laju reaksi.



Mari kita mengingat kembali pelajaran yang telah lalu, agar memudahkan kita dalam mempelajari topik ini.
Laju Reaksi
1.Pengertian Laju Reaksi
Laju reaksi adalah laju pengurangan konsentrasi salah satu pereaksi atau laju penambahan konsentrasi salah satu hasil reaksi setiap satuan waktu.
Reaksi: A + B → C + D
Laju reaksi adalah laju pengurangan konsentrasi salah satu pereaksi atau laju penambahan konsentrasi salah satu hasil reaksi setiap satuan waktu.
Reaksi: A + B → C + D

Apakah kalian sudah ingat kembali?
2. Menentukan Orde Reaksi
Orde reaksi adalah besarnya pengaruh konsentrasi pereaksi terhadap laju reaksi. Orde reaksi dapat ditentukan berdasarkan data percobaan dengan menggunakan persamaan umum laju reaksi. Adapun persamaan umum laju reaksi untuk reaksi p A+q B → r C+ s D adalah :
v = k[A]x[B]y;
v = laju reaksi;
k = konstanta laju reaksi; dan
[ A ] = konsentrasi pereaksi A.
[ B ] = konsentrasi pereaksi B
x = orde reaksi terhadap A
y = orde reaksi terhadap B
x + y = orde reaksi total
2. Menentukan Orde Reaksi
Orde reaksi adalah besarnya pengaruh konsentrasi pereaksi terhadap laju reaksi. Orde reaksi dapat ditentukan berdasarkan data percobaan dengan menggunakan persamaan umum laju reaksi. Adapun persamaan umum laju reaksi untuk reaksi p A+q B → r C+ s D adalah :
v = k[A]x[B]y;
v = laju reaksi;
k = konstanta laju reaksi; dan
[ A ] = konsentrasi pereaksi A.
[ B ] = konsentrasi pereaksi B
x = orde reaksi terhadap A
y = orde reaksi terhadap B
x + y = orde reaksi total
Points
Langkah-langkah penentuan orde reaksi yaitu sebagai berikut.
1. Memilih 2 data percobaan yang salah satunya mempunyai konsentrasi yang sama.
2. Bandingkan 2 data percobaan tersebut dengan memasukkannya ke dalam persamaan umum laju reaksi.
1. Memilih 2 data percobaan yang salah satunya mempunyai konsentrasi yang sama.
2. Bandingkan 2 data percobaan tersebut dengan memasukkannya ke dalam persamaan umum laju reaksi.
Mari kita perhatikan contoh-contoh soal berikut ini.
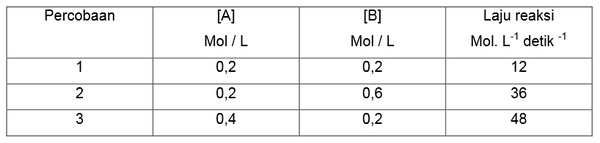
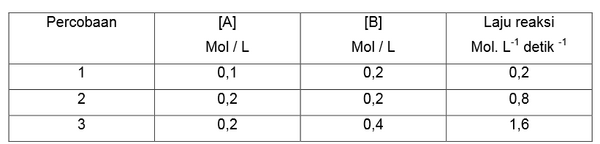
Contoh 1
Tentukan masing-masing orde reaksi A dan B berdasarkan data percobaan sebagai berikut.
2A (g) + B (g) → 2AB
Contoh 1
Tentukan masing-masing orde reaksi A dan B berdasarkan data percobaan sebagai berikut.
2A (g) + B (g) → 2AB

Penyelesaian
v = k [A]x [B]y
Langkah-langkah penentuan orde reaksi yaitu sebagai berikut.
1.Memilih 2 data percobaan yang salah satunya mempunyai konsentrasi yang sama
a. Untuk mencari orde reaksi A maka perhatikan [ B ] yang sama : Percobaan 1 dan 3
b. Untuk mencari orde reaksi B maka perhatikan [ A ] yang sama : Percobaan 1 dan 2
2.Bandingkan 2 data percobaan tersebut dengan memasukkannya kedalam persamaan umum laju reaksi. Percobaan 1 dan 3
v = k [A]x [B]y
Langkah-langkah penentuan orde reaksi yaitu sebagai berikut.
1.Memilih 2 data percobaan yang salah satunya mempunyai konsentrasi yang sama
a. Untuk mencari orde reaksi A maka perhatikan [ B ] yang sama : Percobaan 1 dan 3
b. Untuk mencari orde reaksi B maka perhatikan [ A ] yang sama : Percobaan 1 dan 2
2.Bandingkan 2 data percobaan tersebut dengan memasukkannya kedalam persamaan umum laju reaksi. Percobaan 1 dan 3

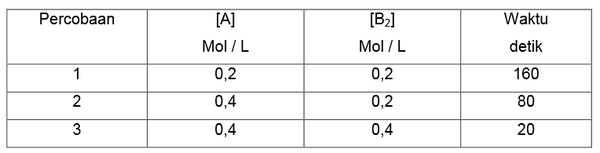
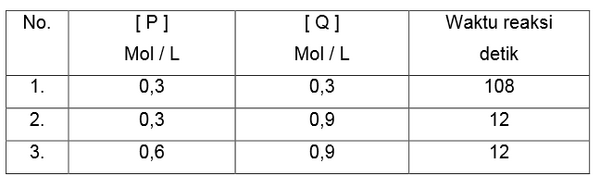
Contoh 2
Tentukan masing-masing orde reaksi A dan B berdasarkan data percobaan sebagai berikut.
2 A (g) + B2 (g) → C (g) + D (g)
Tentukan masing-masing orde reaksi A dan B berdasarkan data percobaan sebagai berikut.
2 A (g) + B2 (g) → C (g) + D (g)

Penyelesaian
v = k [A]x[B]y
Langkah-langkah penentuan orde reaksi yaitu sebagai berikut.
1. Memilih 2 data percobaan yang salah satunya mempunyai konsentrasi yang sama
a. Untuk mencari orde reaksi A maka perhatikan [ B ] yang sama : Percobaan 1 dan 2
b. Untuk mencari orde reaksi B maka perhatikan [ A ] yang sama : Percobaan 2 dan 3
2. Bandingkan 2 data percobaan tersebut dengan memasukkannya kedalam persamaan umum laju reaksi.
v = k [A]x[B]y
Langkah-langkah penentuan orde reaksi yaitu sebagai berikut.
1. Memilih 2 data percobaan yang salah satunya mempunyai konsentrasi yang sama
a. Untuk mencari orde reaksi A maka perhatikan [ B ] yang sama : Percobaan 1 dan 2
b. Untuk mencari orde reaksi B maka perhatikan [ A ] yang sama : Percobaan 2 dan 3
2. Bandingkan 2 data percobaan tersebut dengan memasukkannya kedalam persamaan umum laju reaksi.

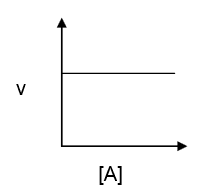
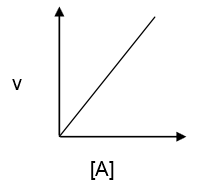
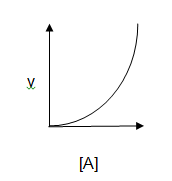
3. Grafik Orde Reaksi
a. Reaksi orde nol: laju reaksi tetap, tidak bergantung terhadap konsentrasi pereaksi.
a. Reaksi orde nol: laju reaksi tetap, tidak bergantung terhadap konsentrasi pereaksi.

b. Reaksi orde satu: laju reaksi berbanding lurus terhadap konsentrasi pereaksi.

c. Reaksi orde dua: laju reaksi berubah secara kuadrat terhadap konsentrasi pereaksi.

S1
NO dapat bereaksi dengan O2. Reaksi tersebut mempunyai orde dua terhadap NO dan mempunyai orde satu terhadap O2. Jika konsentrasi kedua pereaksi diperbesar menjadi 3 kali semula, maka laju reaksinya menjadi….
S2
Berikut ini yang merupakan grafik orde reaksi nol adalah....
S3
Suatu reaksi mempunyai laju v = k[A][B]2. Jika konsentrasi masing-masing pereaksi diperbesar empat kali, maka laju reaksinya menjadi....
S4
Pengukuran laju reaksi menghasilkan data sebagai berikut.

Berdasarkan data di atas, orde reaksi totalnya adalah....
S5
Data hasil percobaan reaksi A + B → C + D ditunjukkan sebagai berikut.

Orde reaksi totalnya adalah....
S6
Suatu reaksi mempunyai persamaan laju reaksi v = k[M]2[N]. Jika konsentrasi masing-masing pereaksi diperkecil menjadi setengahnya, maka laju reaksinya menjadi….
S7
Rumus laju reaksi yang benar untuk persamaan P + Q → R + S adalah....
S8
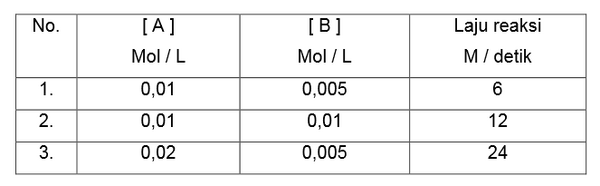
Dalam suatu eksperimen dengan laju reaksi A + B → C diperoleh data sebagai berikut.

Berdasarkan data di atas, orde reaksi A adalah.…
S9
Reaksi antara Cl2 dan gas NO menghasilkan gas NOCl. Saat konsentrasi kedua pereaksi dinaikkan dua kali, laju reaksinya menjadi 16 kali semula. Jika yang dinaikkan dua kali hanya konsentrasi Cl2, maka laju reaksinya menjadi dua kali semula. Orde reaksi NO adalah….
S10
Pada reaksi A + B → C dihasilkan reaksi berorde satu terhadap B. Hubungan reaksi awal dengan konsentrasi B diperlihatkan oleh grafik….
