Contoh Soal Teori tumbukan
Contoh Soal Teori tumbukan - Pada topik sebelumnya, kalian telah mempelajari tentang pengertian laju reaksi. Pada topik ini, kalian akan mempelajari teori tumbukan dan hubungan teori tumbukan dengan laju reaksi.
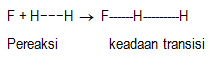
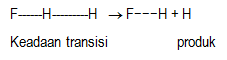

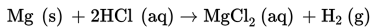
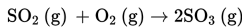
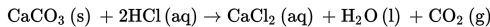
Teori Tumbukan
1. Teori Tumbukan
Menurut teori, sebelum bereaksi partikel-partikel zat pereaksi akan mengalami tumbukan. Tidak semua tumbukan berhasil membentuk zat hasil reaksi. Tumbukan yang baik adalah yang mampu menghasilkan energi. Energi hasil tumbukan itulah yang digunakan untuk merenggangkan atau memutuskan ikatan atom-atom dalam zat pereaksi pada awal proses reaksi kimia. Selanjutnya energi ini disebut energi aktivasi, yaitu energi minimum yang diperlukan oleh zat-zat pereaksi untuk membentuk zat hasil reaksi.
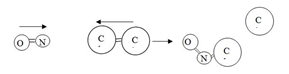
Tumbukan dengan posisi yang benar dan salah dapat ditunjukkan dengan gambar berikut.
Menurut teori, sebelum bereaksi partikel-partikel zat pereaksi akan mengalami tumbukan. Tidak semua tumbukan berhasil membentuk zat hasil reaksi. Tumbukan yang baik adalah yang mampu menghasilkan energi. Energi hasil tumbukan itulah yang digunakan untuk merenggangkan atau memutuskan ikatan atom-atom dalam zat pereaksi pada awal proses reaksi kimia. Selanjutnya energi ini disebut energi aktivasi, yaitu energi minimum yang diperlukan oleh zat-zat pereaksi untuk membentuk zat hasil reaksi.
Tumbukan dengan posisi yang benar dan salah dapat ditunjukkan dengan gambar berikut.

Gambar 1. Posisi Tumbukan yang baik antara spesies pereaksi NO dan Cl2
dalam reaksi NO+Cl2 → NOCl+ Cl
dalam reaksi NO+Cl2 → NOCl+ Cl
2. Teori Keadaan Transisi
Menurut teori ini, sebelum bereaksi zat pereaksi bergerak saling mendekat kemudian berinteraksi membentuk kompleks molekul. Selama berinteraksi terjadi transformasi bentuk dari energi kinetik ke energi potensial. Energi tersebut diserap oleh kompleks molekul untuk membentuk energi potensial tinggi yang mudah bereaksi menghasilkan zat hasil reaksi. Kompleks molekul yang berenergi tinggi dan tidak stabil ini disebut kompleks molekul teraktivasi atau kompleks molekul yang berenergi tinggi.
Berdasarkan teori keadaan transisi, reaksi kimia dapat dilihat sebagai dua tahap. Tahap pertama perubahan pereaksi menjadi keadaan transisi, dan tahap kedua merupakan perubahan keadaan transisi membentuk zat produk. Untuk lebih jelasnya dapat digambarkan sebagai berikut.
Tahap 1. Pembentukan keadaan transisi dari pereaksi
Menurut teori ini, sebelum bereaksi zat pereaksi bergerak saling mendekat kemudian berinteraksi membentuk kompleks molekul. Selama berinteraksi terjadi transformasi bentuk dari energi kinetik ke energi potensial. Energi tersebut diserap oleh kompleks molekul untuk membentuk energi potensial tinggi yang mudah bereaksi menghasilkan zat hasil reaksi. Kompleks molekul yang berenergi tinggi dan tidak stabil ini disebut kompleks molekul teraktivasi atau kompleks molekul yang berenergi tinggi.
Berdasarkan teori keadaan transisi, reaksi kimia dapat dilihat sebagai dua tahap. Tahap pertama perubahan pereaksi menjadi keadaan transisi, dan tahap kedua merupakan perubahan keadaan transisi membentuk zat produk. Untuk lebih jelasnya dapat digambarkan sebagai berikut.
Tahap 1. Pembentukan keadaan transisi dari pereaksi
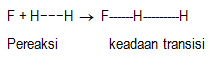
Tahap 2. Perubahan keadaan transisi membentuk produk
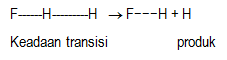
3. Hubungan Tumbukan dengan Laju Reaksi
Suatu reaksi kimia akan dapat berlangsung bila antar zat pereaksi saling mendekat dan kemudian melakukan tumbukan. Tumbukan yang menghasilkan reaksi kimia ditentukan oleh:
a. jumlah energi minimumnya (energi aktivasi) dapat terlewati; dan
b. posisi yang tepat dalam melakukan tumbukannya.
Semakin cepat/banyak tumbukan yang terjadi maka reaksi kimia akan cepat berlangsung, dengan kata lain, semakin cepat tumbukan laju reaksi makin cepat pula.
Suatu reaksi kimia akan dapat berlangsung bila antar zat pereaksi saling mendekat dan kemudian melakukan tumbukan. Tumbukan yang menghasilkan reaksi kimia ditentukan oleh:
a. jumlah energi minimumnya (energi aktivasi) dapat terlewati; dan
b. posisi yang tepat dalam melakukan tumbukannya.
Semakin cepat/banyak tumbukan yang terjadi maka reaksi kimia akan cepat berlangsung, dengan kata lain, semakin cepat tumbukan laju reaksi makin cepat pula.
4. Faktor-faktor yang mempengaruhi Jumlah Tumbukan
a. Pengaruh suhu
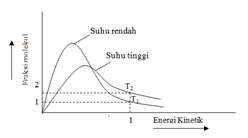
Bila suhu dinaikkan, energi kinetik zat pereaksi akan meningkat sehingga tumbukan yang terjadi juga akan semakin banyak. Peningkatan suhu ini juga dapat memicu terbentuknya energi yang lebih besar dari energi aktivasi reaksi. Untuk lebih jelasnya dapat dilihat pada gambar berikut kurva fraksi molekul terhadap energi kinetik pada suhu T1 yang lebih kecil dari T2 sebagai berikut:
a. Pengaruh suhu
Bila suhu dinaikkan, energi kinetik zat pereaksi akan meningkat sehingga tumbukan yang terjadi juga akan semakin banyak. Peningkatan suhu ini juga dapat memicu terbentuknya energi yang lebih besar dari energi aktivasi reaksi. Untuk lebih jelasnya dapat dilihat pada gambar berikut kurva fraksi molekul terhadap energi kinetik pada suhu T1 yang lebih kecil dari T2 sebagai berikut:

Gambar 2. Kurva fraksi molekul n terhadap energi kinetik pada suhu T
Laju reaksi umumya berubah 2 kali cepat untuk tiap kenaikan suhu 10 .
Pengaruh suhu terhadap laju reaksi dapat dirumuskan sebagai berikut:
Pengaruh suhu terhadap laju reaksi dapat dirumuskan sebagai berikut:

b. Pengaruh Konsentrasi
Semakin tinggi konsentrasi suatu zat, maka jumlah partikelnya akan semakin banyak, akibatnya jumlah tumbukan persatuan waktu juga akan semakin banyak. Misal dalam suatu ruangan terdapat sejumlah partikel A dan B maka jumlah tumbukan antara partikel A dan partikel B dalam satu satuan waktu adalah satu kali. Jika pada suhu tetap dan jumlah partikel A juga tetap sedangkan jumlah partikel B dibuat menjadi 2x jumlah semula maka jumlah tumbukan persatuan waktu menjadi 2x semula. Jika jumlah partikel A dan B masing-masing diubah menjadi 2x semula maka jumlah tumbukan persatuan waktu menjadi 4x dari semula. Jadi jumlah tumbukan antara partikel A dan B sebanding dengan jumlah partikel A kali jumlah partikel B.
Bila jumlah molekul A dan B dinyatakan dalam bentuk konsentrasinya, maka:
jumlah tumbukan persatuan waktu = [A][B], dimana [A] adalah konsentrasi A dan [B] adalah konsentrasi B.
Bila molekul-molekul yang bertumbukan itu ada tiga jenis, misal A, B dan C, maka:
jumlah tumbukan persatuan waktu = v = k[A][B][C], dimana v = laju tumbukan, k = tetapan laju tumbukan.
Semakin tinggi konsentrasi suatu zat, maka jumlah partikelnya akan semakin banyak, akibatnya jumlah tumbukan persatuan waktu juga akan semakin banyak. Misal dalam suatu ruangan terdapat sejumlah partikel A dan B maka jumlah tumbukan antara partikel A dan partikel B dalam satu satuan waktu adalah satu kali. Jika pada suhu tetap dan jumlah partikel A juga tetap sedangkan jumlah partikel B dibuat menjadi 2x jumlah semula maka jumlah tumbukan persatuan waktu menjadi 2x semula. Jika jumlah partikel A dan B masing-masing diubah menjadi 2x semula maka jumlah tumbukan persatuan waktu menjadi 4x dari semula. Jadi jumlah tumbukan antara partikel A dan B sebanding dengan jumlah partikel A kali jumlah partikel B.
Bila jumlah molekul A dan B dinyatakan dalam bentuk konsentrasinya, maka:
jumlah tumbukan persatuan waktu = [A][B], dimana [A] adalah konsentrasi A dan [B] adalah konsentrasi B.
Bila molekul-molekul yang bertumbukan itu ada tiga jenis, misal A, B dan C, maka:
jumlah tumbukan persatuan waktu = v = k[A][B][C], dimana v = laju tumbukan, k = tetapan laju tumbukan.
c. Pengaruh Luas Permukaan Sentuhan
Bila luas permukaan partikel pereaksi besar, maka bagian yang mampu bertumbukan juga akan semakin luas pula. Hal tersebut tentu saja membuat jumlah tumbukan yang terjadi akan semakin banyak.
d. Pengaruh Katalis
Katalis adalah senyawa pemercepat reaksi yang mampu terbentuk kembali di akhir reaksi. Dengan kata lain, selama mempercepat proses reaksi, katalis tidak ikut bereaksi. Dalam hal ini, katalis berperan menurunkan energi aktivasi. Katalis dapat mengubah langkah-langkah reaksi dari yang berenergi aktivasi tinggi ke energi aktivasi rendah. Bila dalam campuran zat pereaksi diberi katalisator maka jumlah tabrakan antarpartikel pereaksi akan menghasilkan energi yang lebih besar dari energi aktivasi reaksi.
Bila luas permukaan partikel pereaksi besar, maka bagian yang mampu bertumbukan juga akan semakin luas pula. Hal tersebut tentu saja membuat jumlah tumbukan yang terjadi akan semakin banyak.
d. Pengaruh Katalis
Katalis adalah senyawa pemercepat reaksi yang mampu terbentuk kembali di akhir reaksi. Dengan kata lain, selama mempercepat proses reaksi, katalis tidak ikut bereaksi. Dalam hal ini, katalis berperan menurunkan energi aktivasi. Katalis dapat mengubah langkah-langkah reaksi dari yang berenergi aktivasi tinggi ke energi aktivasi rendah. Bila dalam campuran zat pereaksi diberi katalisator maka jumlah tabrakan antarpartikel pereaksi akan menghasilkan energi yang lebih besar dari energi aktivasi reaksi.
S1
Berdasarkan teori tumbukan, suhu mempercepat jalannya laju reaksi dengan cara...
S2
Reaksi logam magnesium dengan larutan HCl adalah sebagai berikut.
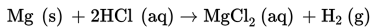
- Meningkatkan konsentrasi larutan HCl
- Meningkatkan suhu reaksi
- Menggunakan pita magnesium
- Menghilangkan gas hidrogen hasil reaksi Dari perlakuan di atas yang dapat meningkatkan tumbukan antarpereaksi adalah....
S3
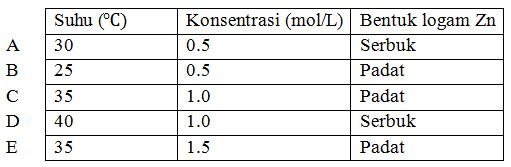
Empat gram logam Zn bereaksi dengan 100 mL larutan HCl pada berbagai kondisi yang ditunjukkan pada tabel di bawah ini.

Gas oksigen paling banyak akan terbentuk pada kondisi....
S4
Dalam suatu pabrik, proses pembuatan SO3 memanfaatkan katalis vanadium pentaoksida menurut persamaan reaksi berikut.
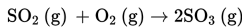
Fungsi katalis dalam reaksi tersebut adalah....
S5
Suatu reaksi pada suhu 15oC berlangsung hingga selesai selama 10 menit. Setiap kenaikan 15oC laju reaksi menjadi 2 kali lebih cepat. Jika suhu dinaikkan menjadi 75oC maka reaksi tersebut akan berlangsung selama....
S6
Cara-cara berikut dapat meningkatkan laju reaksi, kecuali....
S7
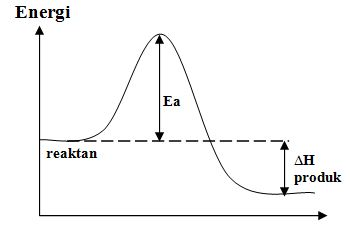
Diagram energi untuk suatu reaksi tanpa katalis ditunjukkan oleh grafik di bawah ini.

Reaksi tersebut diulang dengan menggunakan suatu katalis. Pengaruh adanya katalis dalam reaksi tersebut terhadap nilai energi aktivasi (Ea) adalah....
S8
Gas CO2 terbentuk saat CaCO3 direaksikan dengan asam klorida menurut persamaan reaksi berikut.
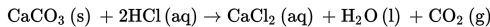
Perlakuan yang dapat mengubah laju awal pembentukan gas CO2 adalah....
S9
Kerja katalis dalam mempercepat reaksi adalah sebagai berikut, kecuali....
S10
Reaksi antara asam sulfat (H2SO4) dengan magnesium karbonat (MgCO3) diberi perlakuan pada berbagai kondisi. Kondisi yang menghasilkan laju reaksi optimum adalah....
