Contoh Soal Konsep Laju reaksi
Contoh Soal Konsep Laju reaksi - Pada pelajaran fisika, kalian telah mengenal besaran kecepatan atau kelajuan. Pada kimia, kecepatan atau kelajuan juga menjadi salah satu bahasan utama. Kelajuan dalam kimia, berkaitan dengan reaksi. Dalam topik ini, kalian akan mempelajari laju reaksi khususnya pengertian laju reaksi.

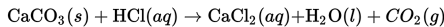

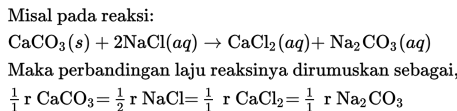
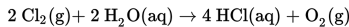
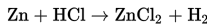
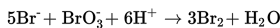
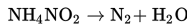
Mari kita ingat kembali pengertian kecepatan, sebelum masuk ke topik pengertian laju reaksi.
KONSEP LAJU REAKSI
1. Konsep Kecepatan
Kecepatan diartikan jumlah jarak yang ditempuh oleh suatu benda tiap satuan waktu. Secara matematis, kecepatan dapat dirumuskan sebagai:
Kecepatan diartikan jumlah jarak yang ditempuh oleh suatu benda tiap satuan waktu. Secara matematis, kecepatan dapat dirumuskan sebagai:

Di dalam kimia, kecepatan ini dihubungkan dengan kecepatan reaksi yang disebut dengan laju reaksi. Untuk lebih memahaminya, mari kita perhatikan penjelasan berikut
2. Konsep Laju Reaksi
Kata laju mempunyai hubungan dengan selang waktu. Apabila waktu yang diperlukan singkat, berarti laju reaksinya besar. Sebaliknya, jika selang waktunya panjang, dikatakan bahwa laju reaksinya kecil. Jadi, laju berbanding terbalik dengan waktu. Reaksi kimia menyatakan perubahan suatu zat menjadi zat lain, yaitu perubahan suatu pereaksi menjadi hasil reaksi. Perubahan ini dinyatakan dalam sebuah persamaan reaksi. Di dalam sebuah persamaan reaksi, jumlah relatif zat-zat pereaksi dan hasil reaksi dapat dilihat dari koefisien reaksinya.
Kata laju mempunyai hubungan dengan selang waktu. Apabila waktu yang diperlukan singkat, berarti laju reaksinya besar. Sebaliknya, jika selang waktunya panjang, dikatakan bahwa laju reaksinya kecil. Jadi, laju berbanding terbalik dengan waktu. Reaksi kimia menyatakan perubahan suatu zat menjadi zat lain, yaitu perubahan suatu pereaksi menjadi hasil reaksi. Perubahan ini dinyatakan dalam sebuah persamaan reaksi. Di dalam sebuah persamaan reaksi, jumlah relatif zat-zat pereaksi dan hasil reaksi dapat dilihat dari koefisien reaksinya.
Definisi Laju Reaksi
- Perubahan konsentrasi pereaksi atau hasil reaksi persatuan waktu.
- Banyaknya mol zat per liter (untuk gas atau larutan) yang berubah menjadi zat lain per satuan waktu.
Untuk lebih memahaminya, perhatikan contoh berikut.
Contoh
Reaksi pualam dengan asam klorida berikut.
Contoh
Reaksi pualam dengan asam klorida berikut.
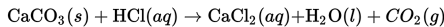
Selama reaksi berlangsung, terjadi hal-hal berikut:
• berkurangnya massa padatan pualam, CaCO3;
• berkurangnya jumlah asam klorida, HCl(aq);
• peningkatan jumlah larutan CaCl2; dan
• peningkatan volume gas karbon dioksida CO2 yang dihasilkan.
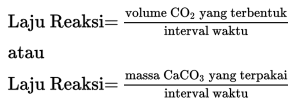
Laju reaksi dapat ditentukan dengan mengamati salah satu perubahan di atas, yang menunjukkan laju reaksi bagi spesies yang bersangkutan.
Berdasarkan reaksi di atas, laju reaksi dapat dirumskan sebagai berikut.
• berkurangnya massa padatan pualam, CaCO3;
• berkurangnya jumlah asam klorida, HCl(aq);
• peningkatan jumlah larutan CaCl2; dan
• peningkatan volume gas karbon dioksida CO2 yang dihasilkan.
Laju reaksi dapat ditentukan dengan mengamati salah satu perubahan di atas, yang menunjukkan laju reaksi bagi spesies yang bersangkutan.
Berdasarkan reaksi di atas, laju reaksi dapat dirumskan sebagai berikut.

Laju reaksi biasanya disimbolkan dengan r, sedangkan perubahan yang umumnya diukur adalah perubahan konsentrasi (M) baik dari zat yang dihasilkan maupun dari pereaksi, sehingga laju reaksi dapat dituliskan secara matematis sebagai berikut.

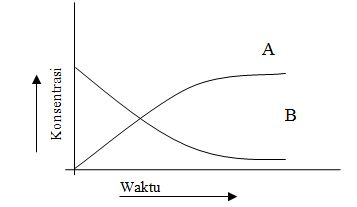
Hubungan perubahan konsentrasi dan waktu untuk zat pereaksi dan zat hasil reaksi dapat digambarkan dalam grafik sebagai berikut.

Gambar 1. Perubahan Konsentrasi Pereaksi A dan hasil Reaksi B terhadap waktu t
Pada awal reaksi, konsentrasi pereaksi A harganya maksimal, sedangkan konsentrasi zat hasil reaksi B harganya = 0 atau zat B belum terbentuk.
Laju reaksi pada awal reaksi berlangsung cepat sehingga konsentrasi pereaksi A berkurang dengan cepat sisanya makin kecil, sebaliknya konsentrasi zat hasil reaksi B bertambah dengan cepat hasilnya makin besar.
Laju reaksi pada awal reaksi berlangsung cepat sehingga konsentrasi pereaksi A berkurang dengan cepat sisanya makin kecil, sebaliknya konsentrasi zat hasil reaksi B bertambah dengan cepat hasilnya makin besar.
Perbandingan Laju Reaksi
Laju reaksi antar spesies dalam suatu reaksi dapat pula dihitung melalui perbandingan koefisien senyawa yang bereaksi.
Laju reaksi antar spesies dalam suatu reaksi dapat pula dihitung melalui perbandingan koefisien senyawa yang bereaksi.
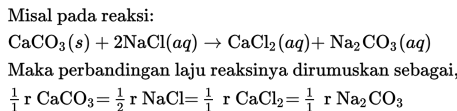
Perbandingan laju reaksi tersebut dapat digunakan untuk menentukan proses yang terjadi antara produk dan reaktan.
S1
Jika terdapat reaksi Mg(OH)2 + 2HCl→MgCl2 + 2H2O, maka pernyataan yang tepat untuk menjelaskan laju reaksi tersebut adalah....
S2
Kecepatan suatu reaksi A + B → C + D pada setiap waktu dapat dinyatakan dengan....
S3
Pada reaksi NO + Cl2 → NOCl2, sebanyak 0,71 gram gas klor (Ar =35,5) bereaksi selama 2 detik. Laju reaksi pembentukan NOCl2 adalah ....
S4
Pada reaksi 2AB → A2 + 2B, terurai 90% AB dengan waktu pembentukan A2 adalah 2,5 detik. Jika tersedia 0,5 M AB maka laju reaksi A2 adalah....
S5
Suatu zat X memiliki laju reaksi 0,1 mol/detik. Jika Ar X sebesar 23, maka jumlah zat X yang telah bereaksi selama 1 menit adalah....
S6
Pada reaksi
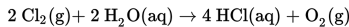
Terbentuk 1,2 liter gas oksigen selama 5 menit. Volume gas klor (Cl2) yang telah bereaksi selama 2 menit adalah....
S7
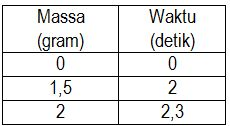
Suatu reaksi menghasilkan logam Na seperti pada tabel berikut ini.

Laju reaksi logam Na tersebut adalah....
S8
Logam Zn bereaksi dengan larutan HCl menurut reaksi berikut.
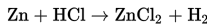
Agar didapatkan laju reaksi yang tinggi, larutan yang sebaiknya digunakan adalah.... (Ar H= 1, Cl = 35.5)
S9
Reaksi ion bromida dan ion bromate dalam asam mengikuti persamaan berikut.
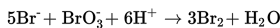
Jika kecepatan pembentukan air adalah 2v, maka kecepatan berkurangnya ion bromida adalah....
S10
Ammonium nitrit (NH4NO2) terurai menurut persamaan berikut.
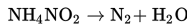
Konsentrasi ammonium nitrit mula-mula 0,6 M. Dua jam kemudian menjadi 0,24 M. Laju penguraian ammonium nitrit dalam molar per detik (M/detik) adalah....
