Contoh Soal Faktor yang mempengaruhi Laju Reaksi
Contoh Soal Faktor yang mempengaruhi Laju Reaksi - Kecepatan yang dibutuhkan oleh reaktan berubah menjadi produk disebut dengan laju reaksi. Molekul reaktan memiliki energi kinetik dengan jangkauan cukup luas.Namun hanya sebagian kecil dari partikel yang memiliki energi kinetik yang cukup untuk menembus jaringan sehingga menghasilkan reaksi kimia.
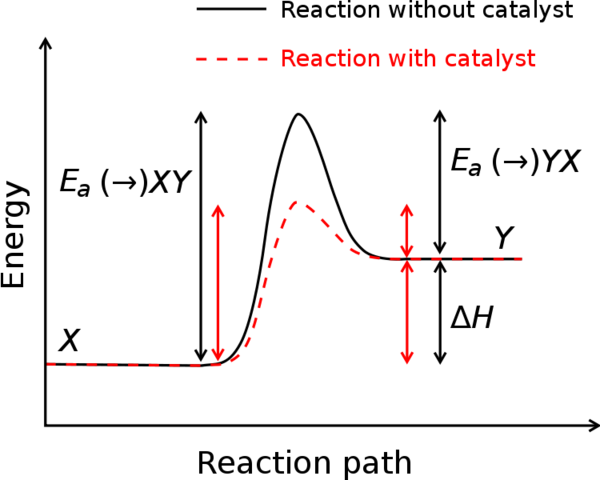
Energi minimum yang harus ditimbulkan agar reaksi kimia dapat terjadi, inilah yang disebut dengan energi aktivasi atau energi awal.
Energi aktivasi lebih besar daripada partikel reaktan pada kondisi normal. Hanya tumbukan yang memiliki energi yang sama atau lebih besar daripada energi aktivasi akan menghasilkan pembentukan produk. Jika energi tumbukan lebih kecil daripada energi aktivasi, maka partikel akan terpental.

Hubungan antara temperatur dan energi aktivasi
Partikel individu dalam sebuah substansi memiliki energi kinetik yang berbeda. Beberapa dari partikel bergerak perlahan, sebagian lainnya bergerak cepat dan sebagian besar partikel bergerak dalam kecepatan menengah. Saat meningkatkan temperatur, energi panas yang didapat akan meningkatkan energi kinetik pada partikel. Kemudian partikel akan memperoleh energi kinetik awal, yaitu sejumlah energi minimum yang dibutuhkan partikel reaktan untuk bereaksi. Energi ini mirip dengan energi aktivasi yang merupakan level energi yang harus ditimbulkan agar sebuah reaksi dapat terjadi. Jumlah molekul dengan energi lebih besar atau sama dengan energi aktivasi juga akan meningkat. Maka peluang terjadinya tumbukan yang berhasil meningkat seiring dengan meningkatnya laju reaksi. Pada sebagian besar reaksi, laju reaksi bertambah untuk setiap peningkatan temperatur 10⁰.
Peningkatan temperatur juga meningkatkan jumlah tumbukan yang berhasil dan laju reaksi. Namun ini hanyalah faktor minor. Meningkatnya jumlah molekul yang memiliki energi hampir sama atau sama besar dengan energi aktivasi setelah naiknya temperatur adalah faktor utama yang menentukan laju reaksi.
Hubungan antara katalisator dan energi aktivasi
Katalisator adalah sebuah substansi yang meningkatkan laju reaksi. Namun substansi ini tidak berubah secara kimiawi dan jumlahnya tetap pada saat reaksi berakhir. Hal ini meningkatkan laju reaksi dengan menyediakan jalur alternatif untuk reaksi dengan energi aktivasi lebih rendah. Sehingga partikel reaktan mempunyai energi minimum yang dibutuhkan untuk memecah jaringan dan meningkatkan laju reaksi.
Katalisator mengurangi energi aktivasi
- Dengan mengubah orientasi relatif pada partikel reaktan.
- Menyediakan jalur alternatif bagi reaksi.
- Menyumbangkan kepadatan elektron pada partikel reaktan.
- Mengurangi ikatan antar molekul pada partikel reaktan.
Efek dari tekanan atau konsentrasi pada laju reaksi
Tekanan mempengaruhi laju reaksi yang melibatkan reaktan gas, dimana zat ini harus ditekan hingga memiliki volume lebih kecil. Karena adanya massa yang sama pada volume yang lebih kecil, tekanan dan konsentrasi meningkat. Sekarang partikel reaktan memiliki ruang lebih sempit untuk bergerak. Hal ini meningkatkan peluang tumbukan yang berhasil dan dengan sendirinya meningkatkan laju reaksi.
Meningkatkan volume gas akan menurunkan tekanan dan turut menurunkan konsentrasi, jumlah tumbukan yang berhasil dan laju reaksi.
Efek dari areal permukaan pada laju reaksi
Areal permukaan adalah bagian utama bagi sebuah substansi padat. Hal ini dapat ditingkatkan dengan menghaluskan reaktan padat, meningkatkan frekuensi tumbukan yang berhasil, menghasilkan laju reaksi lebih tinggi.
S1
Apakah yang disebut dengan energi minimum yang dibutuhkan agar sebuah reaksi kimia dapat terjadi?
S2
Penambahan sebuah katalisator dapat meningkatkan laju reaksi dengan ............
S3
Laju reaksi kimia mengalami penurunan dengan sebuah peningkatan pada ........
S4
Manakah pernyataan berikut ini yang tepat mengenai katalisator?
S5
Mengapa laju reaksi meningkat saat suhu dinaikkan?
S6
Bagaimana kalian dapat mengurangi energi aktifasi?
S7

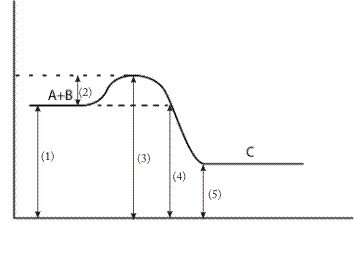
Terdapat sebuah reaksi kimia A + B → C.
Grafik menunjukkan progresi reaksi pada sumbu x dan energi pada sumbu y. Manakah angka yang menunjukkan energi aktifasi?
S8
Pada sebuah kompor gas, sebuah kumparan digunakan untuk menyalakan gas. Apakah fungsi dari kumparan tersebut?
S9
Energi aktifasi sebuah reaksi kimia sangat besar. Manakah pernyataan yang paling tepat tentang reaksi tersebut?
S10
Manakah pernyataan yang tepat berikut ini?
- Sebuah peningkatan pada temperatur akan meningkatkan energi aktifasi.
- Sebuah peningkatan pada temperatur akan mengurangi energi aktifasi.
- Sebuah peningkatan pada temperatur akan meningkatkan energi kinetik pada partikel.
- Sebuah peningkatan pada temperatur tidak berpengaruh terhadap energi aktifasi.
- Penggunaan katalisator mengurangi energi aktifasi.
