Contoh Soal Menentukan kelarutan garam dalam larutan ion sejenis
Contoh Soal Menentukan kelarutan garam dalam larutan ion sejenis - Dalam pertemuan ini kita akan membahas tentang penentuan kelarutan garam dalam larutan ion sejenis. Sebelumnya kalian pasti telah mempelajari tentang kelarutan garam dalam air dan hasil kali kelarutan ( Ksp ).
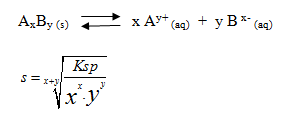
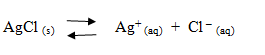
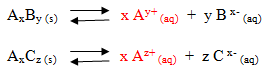
2. Menentukan hubungan antara konsentrasi ion-ion dengan kelarutan berdasarkan koefisien reaksinya.

3. Mensubstitusikan nilai konsentrasi ion sejenis dalam rumus hasil kali kelarutan.
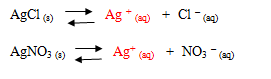
3. Mensubstitusikan nilai konsentrasi ion sejenis ke dalam rumus hasil kali kelarutan.
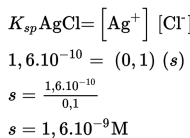
Mari kita mengingat kembali tentang kelarutan garam dalam air dan hasil kali kelarutan, agar memudahkan kita dalam mempelajari topik ini.
1. Kelarutan Garam dalam Air
Kelarutan digunakan untuk menyatakan jumlah maksimum suatu zat yang dapat larut di dalam suatu pelarut, sedangkan defenisi kelarutan garam dalam air adalah konsentrasi maksimum suatu garam sampai tercapai keadaan tepat jenuh. Reaksi kesetimbangan larutan jenuh senyawa ion AxBy dalam air.
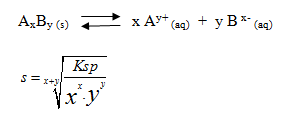
Keterangan
s = kelarutan
Ksp = hasil kali kelarutan
x = bilangan yang diikat kation
y = bilangan yang diikat anion
s = kelarutan
Ksp = hasil kali kelarutan
x = bilangan yang diikat kation
y = bilangan yang diikat anion
2. Hasil kali kelarutan
Jika kita melarutkan AgCl tersebut dalam air, ternyata hanya sedikit garam AgCl yang larut. Pada saat keadaan jenuh tersebut terdapat kesetimbangan antara zat padat tak larut dengan ion-ionnya. Tetapan kesetimbangan antara garam atau basa yang sedikit larut disebut tetapan hasil kali kelarutan (Ksp).
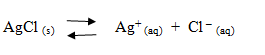
Sesuai dengan azas Le Chatelier, apabila ke dalam larutan tersebut ditambahkan ion Ag+ atau ion Cl- ( ion sejenis ) maka kesetimbangan akan bergeser ke kiri. Hal ini menyebabkan AgCl akan semakin banyak mengendap. Oleh karena itu, adanya penambahan ion sejenis akan memperkecil kelarutan elektrolit. Jika semakin besar konsentrasi ion sejenis, maka kelarutan elektrolit akan semakin kecil.
Langkah - langkah menentukan kelarutan garam dalam larutan ion sejenis
1. Tentukan ion yang sejenis pada larutan garam
Langkah - langkah menentukan kelarutan garam dalam larutan ion sejenis
1. Tentukan ion yang sejenis pada larutan garam
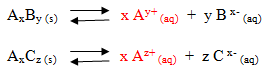
2. Menentukan hubungan antara konsentrasi ion-ion dengan kelarutan berdasarkan koefisien reaksinya.

3. Mensubstitusikan nilai konsentrasi ion sejenis dalam rumus hasil kali kelarutan.
Contoh Soal
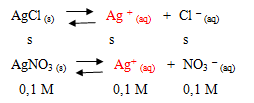
Diketahui Ksp AgCl = 1,6 x 10-10. Tentukan kelarutan AgCl dalam larutan AgNO3 0,1 M !
Penyelesaian
1. Tentukan ion yang sejenis pada larutan garam
Diketahui Ksp AgCl = 1,6 x 10-10. Tentukan kelarutan AgCl dalam larutan AgNO3 0,1 M !
Penyelesaian
1. Tentukan ion yang sejenis pada larutan garam
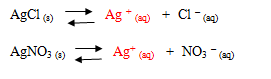
Ion sejenis adalah Ag+.
2. Menentukan hubungan antara konsentrasi ion-ion dengan kelarutan berdasarkan koefisien reaksinya.
2. Menentukan hubungan antara konsentrasi ion-ion dengan kelarutan berdasarkan koefisien reaksinya.

3. Mensubstitusikan nilai konsentrasi ion sejenis ke dalam rumus hasil kali kelarutan.
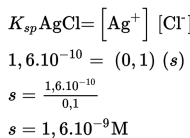
Jadi, kelarutan AgCl dalam larutan AgNO3 0,1 M adalah 1,6 x 10-9 M.
S1
Kelarutan PbI2 ( Ksp = 1,6.10-8) dalam larutan Pb ( NO3 )2 0,001 M adalah ....
S2
Jika kelarutan CaCO3 ( Mr = 100) dalam 250 ml air adalah 2,5 mg, maka nilai Ksp CaCO3 adalah ....
S3
Kelarutan AgCl ( Ksp = 1,6.10-10 ) dalam larutan CaCl2 0,2 M adalah ....
S4
Jika Ksp PbCO3 adalah 16z2, maka kelarutan garam tersebut dalam air adalah ....
S5
Kelarutan PbSO4 ( Ksp = 2.10-8 ) dalam larutan PbCl2 0,2 M adalah ....
S6
Senyawa yang mempunyai kelarutan besar di dalam air adalah ....
S7
Kelarutan CaCO3 ( Ksp = 4,8.10-9) dalam larutan Ca3(PO4)2 0,1 M adalah ....
S8
Jika Ksp AgCN = 1.10-16, maka kelarutan AgCN dalam air adalah ....
S9
Jika kelarutan Ag2CrO4 ( Mr = 332 ) dalam 250 ml air adalah 8,3 mg, maka kelarutan Ag2CrO4 dalam larutan AgI 0,4 M adalah ....
S10
Garam berikut ini yang mempunyai ion sejenis dengan PbCl2 adalah ....
