Contoh Soal Menentukan kelarutan garam dalam air
Contoh Soal Menentukan kelarutan garam dalam air - Dalam pertemuan ini kita akan membahas tentang penentuan kelarutan garam dalam air. Sebelum kita membahas topik ini, mari terlebih dahulu kita mempelajari tentang pengertian kelarutan.
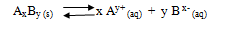
2. Menentukan nilai x dan y (bilangan yang diikat kation dan bilangan yang diikat anion).
3. Memasukkan nilai Ksp kedalam rumus berikut.
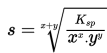
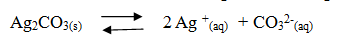
2. Menentukan nilai x dan y (bilangan yang diikat kation dan bilangan yang diikat anion). Nilai x = 2 dan nilai y = 1
3. Memasukkan nilai Ksp ke dalam rumus berikut.
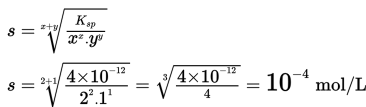
Apa yang terjadi saat kalian menambahkan satu sendok garam dapur ke dalam segelas air? Garam dapur tersebut tentu akan larut dalam air saat diaduk. Akan tetapi, saat kita menambahkan garam dapur tersebut secara terus menerus ke dalam air, ternyata garam tidak dapat larut sempurna. Hal ini dikarenakan larutan garam dapur tersebut telah menjadi jenuh, sehingga garam tidak dapat larut lagi. Kelarutan digunakan untuk menyatakan jumlah maksimum suatu zat yang dapat larut di dalam suatu pelarut. Besarnya kelarutan dipengaruhi oleh jenis pelarut, jenis zat terlarut dan suhu.
Apakah kalian sudah memahami pengertian kelarutan tersebut? Baiklah, selanjutnya mari kita membahas kelarutan garam dalam air.
Apakah kalian sudah memahami pengertian kelarutan tersebut? Baiklah, selanjutnya mari kita membahas kelarutan garam dalam air.
Kelarutan Dalam Air
Kemampuan garam-garam melarut dalam air berbeda-beda. Ada yang mudah larut dalam air dan ada juga yang sukar larut dalam air.
Beberapa contoh garam yang mudah larut dalam air
a. Semua garam nitrat ( NO3-).
b. Semua garam klorat ( ClO3- ).
c. Semua garam asetat ( CH3COO- ).
d. Semua garam sulfat (SO42-) kecuali garam yang berasal dari logam Ba2+, Ca2+, Sr2+, dan Pb2+.
e. Semua garam halida (Cl-,Br-,I-) kecuali garam yang berasal dari logam Ag+, Hg+, Pb2+, dan HgI2 .
a. Semua garam nitrat ( NO3-).
b. Semua garam klorat ( ClO3- ).
c. Semua garam asetat ( CH3COO- ).
d. Semua garam sulfat (SO42-) kecuali garam yang berasal dari logam Ba2+, Ca2+, Sr2+, dan Pb2+.
e. Semua garam halida (Cl-,Br-,I-) kecuali garam yang berasal dari logam Ag+, Hg+, Pb2+, dan HgI2 .
Beberapa contoh garam yang sukar larut dalam air
a. Semua garam posfat (PO43-) kecuali garam yang berasal dari logam Li+, Na+, K+, NH4+.
b. Semua garam karbonat (CO32-) kecuali garam yang berasal dari logam Li+, Na+, K+, NH4+
c. Semua garam sulfida (S2-) kecuali garam yang berasal dari logam Li+, Na+, K+, NH4+, Ca2+, Sr2+, Ba2+, Mg2+.
d. Semua garam arsenat (AsO32-) kecuali garam yang berasal dari logam Li+, Na+, K+, NH4+
e. Semua garam silikat (SiO32-) kecuali garam yang berasal dari logam Li+, Na+, K+, NH4+.
f. Semua garam sulfit (SO32-) kecuali garam yang berasal dari logam Li+, Na+, K+, NH4+.
a. Semua garam posfat (PO43-) kecuali garam yang berasal dari logam Li+, Na+, K+, NH4+.
b. Semua garam karbonat (CO32-) kecuali garam yang berasal dari logam Li+, Na+, K+, NH4+
c. Semua garam sulfida (S2-) kecuali garam yang berasal dari logam Li+, Na+, K+, NH4+, Ca2+, Sr2+, Ba2+, Mg2+.
d. Semua garam arsenat (AsO32-) kecuali garam yang berasal dari logam Li+, Na+, K+, NH4+
e. Semua garam silikat (SiO32-) kecuali garam yang berasal dari logam Li+, Na+, K+, NH4+.
f. Semua garam sulfit (SO32-) kecuali garam yang berasal dari logam Li+, Na+, K+, NH4+.
Menentukan Kelarutan Garam dalam Air
Kelarutan garam dalam air adalah konsentrasi maksimum suatu garam dalam air sehingga tercapai keadaan tepat jenuh.
Langkah-langkah dalam penentuan kelarutan garam dalam air, yaitu :
1. Membuat reaksi kesetimbangan larutan jenuh senyawa ion AxBy dalam air.
Langkah-langkah dalam penentuan kelarutan garam dalam air, yaitu :
1. Membuat reaksi kesetimbangan larutan jenuh senyawa ion AxBy dalam air.
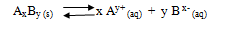
2. Menentukan nilai x dan y (bilangan yang diikat kation dan bilangan yang diikat anion).
3. Memasukkan nilai Ksp kedalam rumus berikut.
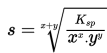
Keterangan:
s = kelarutan
Ksp = hasil kali kelarutan
x = bilangan yang diikat kation
y = bilangan yang diikat anion
s = kelarutan
Ksp = hasil kali kelarutan
x = bilangan yang diikat kation
y = bilangan yang diikat anion
Contoh Soal
Hitunglah kelarutan Ag2CO3 dalam air, jika pada suhu tertentu nilai
Ksp Ag2CO3 = 4 x 10 -12!
Penyelesaian :
Langkah-langkah dalam penentuan kelarutan garam dalam air.
1. Membuat reaksi kesetimbangan larutan Ag2CO3 dalam air
Hitunglah kelarutan Ag2CO3 dalam air, jika pada suhu tertentu nilai
Ksp Ag2CO3 = 4 x 10 -12!
Penyelesaian :
Langkah-langkah dalam penentuan kelarutan garam dalam air.
1. Membuat reaksi kesetimbangan larutan Ag2CO3 dalam air
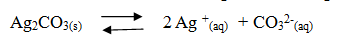
2. Menentukan nilai x dan y (bilangan yang diikat kation dan bilangan yang diikat anion). Nilai x = 2 dan nilai y = 1
3. Memasukkan nilai Ksp ke dalam rumus berikut.
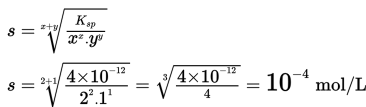
Kelarutan Ag2CO3 dalam air = 10-4 mol/ L.
S1
Jika Ksp AgCl adalah 4b2, maka kelarutan garam tersebut dalam air adalah ....
S2
Berikut ini merupakan contoh garam-garam yang sukar larut dalam air, kecuali ....
S3
Rumus penentuan kelarutan garam dalam air adalah ....
S4
Garam berikut yang memiliki kelarutan paling besar dalam air adalah ....
S5
Contoh garam yang mudah larut dalam air adalah ....
S6
Jika sebanyak 4,35 mg Ag2CrO4 dapat larut dalam 100 mL air, maka kelarutan senyawa tersebut adalah .... (Ar O = 16; Cr = 52; Ag = 108)
S7
Diketahui Data Berikut.
Ksp AgCl = 10-10
Ksp AgI = 10-16
Ksp PbCrO4 = 10-14
Ksp CuS = 10-44
Ksp Ag2CO3 = 4 x 10-12
Diantara senyawa-senyawa diatas, yang paling sukar larut dalam air adalah ....
Ksp AgCl = 10-10
Ksp AgI = 10-16
Ksp PbCrO4 = 10-14
Ksp CuS = 10-44
Ksp Ag2CO3 = 4 x 10-12
Diantara senyawa-senyawa diatas, yang paling sukar larut dalam air adalah ....
S8
Jika Ksp BaSO4 adalah 10-10, maka kelarutan garam tersebut dalam air adalah ....
S9
Contoh garam yang sukar larut dalam air adalah ....
S10
Rumus penentuan kelarutan Ag3PO4 dalam air adalah ....
