Contoh Soal Memprediksi terbentuknya endapan
Contoh Soal Memprediksi terbentuknya endapan - Dalam pertemuan ini kita akan membahas tentang bagaimana memprediksi terbentuknya endapan. Sebelumnya kalian pasti telah mempelajari tentang hasil kali kelarutan ( Ksp ).
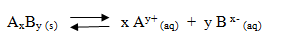
Nilai hasil kali kelarutannya dinyatakan dengan rumus berikut.
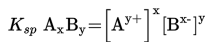
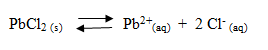
Berdasarkan reaksi tersebut, garam PbCl2 mempunyai Qsp sebagai berikut.
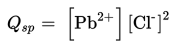

2. Menghitung nilai Qsp
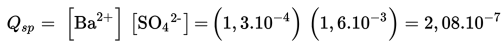
3. Membandingkan nilai Qsp yang didapat dari perhitungan dengan nilai Ksp .
Qsp BaSO4 > Ksp BaSO4 maka BaSO4 mengendap.
Mari kita mengingat kembali tentang hasil kali kelarutan, agar memudahkan kita dalam mempelajari topik ini.
1. Hasil kali kelarutan
Jika kita melarutkan AgCl dalam air, ternyata hanya sedikit garam AgCl yang larut. Pada saat keadaan jenuh tersebut terdapat kesetimbangan antara zat padat tak larut dengan ion-ionnya. Tetapan kesetimbangan dari kesetimbangan antara garam atau basa yang sedikit larut disebut tetapan hasil kali kelarutan ( Ksp ).
Pada larutan jenuh senyawa ion AxBy di dalam air akan menghasilkan reaksi kesetimbangan berikut.
Pada larutan jenuh senyawa ion AxBy di dalam air akan menghasilkan reaksi kesetimbangan berikut.
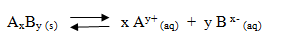
Nilai hasil kali kelarutannya dinyatakan dengan rumus berikut.
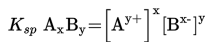
Apakah kalian sudah mengingat kembali tentang hasil kali kelarutan diatas? Baiklah, mari kita membahas bagaimana memprediksi terbentuknya endapan.
2. Memprediksi terbentuknya endapan
Kita dapat memprediksi terjadi atau tidaknya pengendapan berdasarkan nilai Qsp ( quosien reaksi hasil kali kelarutan ) dan nilai Ksp (tetapan hasil kali kelarutan). Qsp adalah hasil kali kelarutan ion-ion dalam larutan setelah dicampurkan. Perhatikan reaksi berikut.
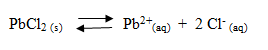
Berdasarkan reaksi tersebut, garam PbCl2 mempunyai Qsp sebagai berikut.
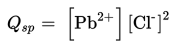
Catatan
a. Jika Qsp < Ksp maka belum terjadi pengendapan.
b. Jika Qsp = Ksp maka larutan tepat mengendap.
c. Jika Qsp > Ksp maka terjadi pengendapan.
b. Jika Qsp = Ksp maka larutan tepat mengendap.
c. Jika Qsp > Ksp maka terjadi pengendapan.
Langkah-langkah memprediksi terbentuknya endapan
1. Menentukan konsentrasi masing-masing ion dari garam tersebut
2. Menghitung nilai Qsp
3. Membandingkan nilai Qsp yang didapat dari perhitungan dengan nilai Ksp .
1. Menentukan konsentrasi masing-masing ion dari garam tersebut
2. Menghitung nilai Qsp
3. Membandingkan nilai Qsp yang didapat dari perhitungan dengan nilai Ksp .
Contoh soal
Sebanyak 100 ml Na2SO4 0,005 M ditambahkan kedalam 200 ml larutan BaCl2 0,0002 M. Apakah terjadi endapan pada pencampuran tersebut? (Ksp BaSO4 = 1,1.10-10).
Langkah-langkah memprediksi terbentuknya endapan
1. Menentukan konsentrasi masing-masing ion dari garam tersebut
Volume Campuran = 100 ml + 200 ml = 300 ml
Sebanyak 100 ml Na2SO4 0,005 M ditambahkan kedalam 200 ml larutan BaCl2 0,0002 M. Apakah terjadi endapan pada pencampuran tersebut? (Ksp BaSO4 = 1,1.10-10).
Langkah-langkah memprediksi terbentuknya endapan
1. Menentukan konsentrasi masing-masing ion dari garam tersebut
Volume Campuran = 100 ml + 200 ml = 300 ml

2. Menghitung nilai Qsp
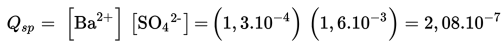
3. Membandingkan nilai Qsp yang didapat dari perhitungan dengan nilai Ksp .
Qsp BaSO4 > Ksp BaSO4 maka BaSO4 mengendap.
S1
Jika larutan AgNO3 10-6 M dan larutan NaBr 2.10-8 M dengan volume yang sama dicampurkan, maka…. (Ksp AgBr = 4.10-13)
S2
Massa PbI2 ( Mr = 462 ) yang dapat larut dalam setiap 100 ml air adalah .... ( Ksp PbI2 = 4.10-9)
S3
Hasil kali kelarutan ( Ksp ) MgCO3 yang memiliki kelarutan 3,2.10-3 mol / L adalah ....
S4
Jika Ksp Ag2CrO4 = 4.10-12, maka kelarutan Ag2CrO4 dalam larutan K2CrO4 0,0001 M adalah ...
S5
Rumusan hasil kali kelarutan (Ksp) Ag2CO3 adalah ....
S6
Jika kedalam 100 ml larutan Pb(NO3)2 0,0001 M ditambahkan 100 ml larutan MgSO4 0,0001 M, maka .... ( Ksp PbSO4 = 2.10-8 )
S7
Larutan yang masih dapat melarutkan zat terlarutnya disebut ....
S8
Jika larutan 250 ml CaCl2 0,002 M dicampurkan dengan 350 ml larutan Na2CO3 0,004 M, maka .... (Ksp CaCO3= 5.10-9 )
S9
Jika larutan 200 ml AgNO3 0,02 M dicampurkan dengan 300 ml larutan Al2(SO4)3 0,05 M, maka .... (Ksp Ag2SO4= 1,5.10-5 )
S10
Larutan garam Pb(NO3)2 dan Zn(NO3)2 masing-masing dengan konsentrasi 0,001 M. Pada larutan ini dilarutkan sejumlah NaOH padat hingga pH larutan menjadi 10. Berdasarkan data Ksp berikut.
Zn(OH)2 = 5.10-17
Pb(OH)2 = 4.10-15
Hidroksida yang mengendap adalah ....
Zn(OH)2 = 5.10-17
Pb(OH)2 = 4.10-15
Hidroksida yang mengendap adalah ....
