Contoh Soal Grup pada Tabel Periodik
Contoh Soal Grup pada Tabel Periodik - Tabel Periodik disusun untuk menunjukkan dua tipe pola, yang disebut grup dan periode, dalam karakteristik kimia dan fisik unsur. Periode didiskusikan secara detil dalam pelajaran lain. Grup, juga disebut keluarga, diindikasikan oleh kolom dalam tabel. Sebagai contoh, beryllium (Be), magnesium (Mg), kalsium (Ca), strontium (Sr), barium (Ba) dan radium (Ra) semua ditemukan pada kolom kedua pada Tabel Periodik. Mereka karenanya milik grup kimia yang sama, Grup 2. Skema penamaan yang resmi untuk grup cukup sederhana dengan angka setiap kolom dari sisi kiri Tabel Periodik ke sisi kanan. Secara total, sistem penamaan berlaku dari Grup 1 hingga Grup 18, dengan lanthanides dan actinides, unsur dengan jumlah atom dari 57 hingga 71 dan dari 89 hingga 103, masing-masing, kadang-kadang diakui sebagai bagian dari Grup 3.
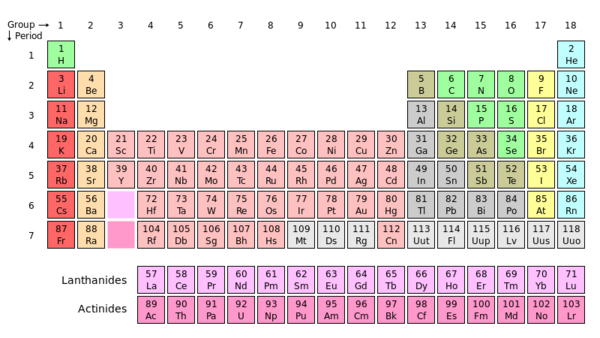

Apa Pola pada Kelompok Unsur-unsur Utama?
Kelompok pada Tabel Periodik dapat ditempatkan secara luas pada dua kategori. Anggota Kelompok 1, 2, dan 13-18 disebutkelompok unsur utama; mereka termasuk unsur yang paling berlimpah di alam. Pada hampir semua kasus, unsur dalam kelompok ini berbagi jumlah elektron yang sama pada shel orbit paling luar, atau elektron valens. Untuk unsur Kelompok 1, metal alkali metal, ini adalah satu elektron yang tidak berpasangan; karena elektron tidak berpasangan ini kehilangan secara mudah, metal alkali biasanya menghasilkan ion dengan muatan +1 atau oksidasi. Begitu juga, unsur Kelompok 2, metal bumi alkalin, terdiri dari dua elektron valens yang dapat kehilangan untuk menghasilkan ion +2. Kelompok 13, atau kelompok boron, secara umum menghasilkan ion +3 (kecuali boron itu sendiri yang tidak membentuk ion) dan mempunyai tiga elektron valens. Sisa lima kelompok, kelompok karbon (14), kelompok nitrogen (15), kelompok oksigen (16), halogen (17), dan gas mulia (18) mempunyai sejumlah elektron valens yang meningkat secara berurutan dengan satu. Pengecualian pada peraturan adalah helium, yang mempunyai shel orbit luar yang penuh yang terdiri dari dua elektron.
Tipe unsur pada Kelompok 13 - 16 beragam turun kelompoknya dari non-metal ke metal. Unsur non-metal di Kelompok13 dan 14 tidak pernah membentuk ion; sebagai gantinya, mereka hanya berbagi ikatan kovalen dengan nonmetal lain untuk membentuk molekul. Sebagai contoh termasuk SiO2 dan BH3. Unsur pada Kelompok 15, 16 dan 17dapat memperoleh elektron untuk membentuk ion -3, -2, and -1, masing-masing, atau berbagi elektron pada ikatan kovalen dengan non-metal lainnya. Karena gas mulai terdiri dari shel orbit luar penuh, mereka secara kimia stabil dan tidak akan siap menggabungkan dengan atom lain atau membentuk ion.
Apakah Karakteristik Unsur pada Sisa Kelompok?
Kategori kelompok kedua termasuk Kelompok 3-12, sering merujuk pada metal transisi. Shel orbit paling luar mereka secara parsial terisi, membuatnya reaktif, dan mereka dapat menghasilkan dua atau lebih oksidan berdekatan, secara umum +2 and +3. Ion menghasilkan beragam tergantung pada unsur; sebagai contoh, osmium dapat menghasilkan oksidan +8, sementara vanadium dapat menghasilkan oksidan dari -1 hingga +5. Elektron pada contoh murni metal transisi dapat juga berpindah dari shel orbit atom individu, atau delocalize, menghasilkan karakteristik seperti konduktivitas listrik, sifat lunak, dan daktilitas.
Kelompok 3 juga termasuk lanthanides dan
actinides. Lanthanides biasanya diakui sebagai metal transisi. Semua menghasilkan ion +3, dan beberapa juga dapat menghasilkan oksidan +2 dan/atau +4. Actinides tidak diakui sebagai metal transisi dan termasuk banyak unsur radioaktif, seperti uranium dan
plutonium. Mereka semua menghasilkan ion +3 dan/atau +4 , dan beberapa mempunyai oksidan berkisar dari +2 to +7.
actinides. Lanthanides biasanya diakui sebagai metal transisi. Semua menghasilkan ion +3, dan beberapa juga dapat menghasilkan oksidan +2 dan/atau +4. Actinides tidak diakui sebagai metal transisi dan termasuk banyak unsur radioaktif, seperti uranium dan
plutonium. Mereka semua menghasilkan ion +3 dan/atau +4 , dan beberapa mempunyai oksidan berkisar dari +2 to +7.
S1
Set manakah dari jumlah atom yang terdiri dari lanthanides?
S2
Kelompok mana yang merupakan satu-satunya yang mengandung tiga kategori unsur yang berbeda?
S3
Apa nama resmi kelompok yang terbuat dari kolom kanan unsur di Tabel Periodik?
S4
Tipe ion apa yang beryllium paling banyak hasilkan? (Nilai dalam tanda kurung di pilihan di bawah mengindikasikan muatan.)
S5
Berapa banyak elektron valens ditemukan pada setiap atom di metana(CH4) sebelum molekul terbentuk?
S6
Mana dari berikut ini BUKAN merupakan fitur umum semua metal transisi?
S7
Diketahui bahwa xenon (Xe) mempunyai shel orbit luar dengan delapan elektron, apakah ini cenderung membentuk senyawa H2Ca3Xe? Mengapa atau mengapa tidak?
S8
Apa perbedaan terbesar antara unsur pada Kelompok 1, 2, dan 13-18 dibandingkan dengan Kelompok 3-12?
S9
Mana yang merupakan cara yang paling tepat untuk menggambarkan kelembutan unsur kelompok utama untuk memperoleh atau kehilangan elektron secara keseluruhan?
S10
Diberikan sebuat contoh murni suatu unsur yang kelihatan bersinar, kelihatan seperti perak, seorang kimiawan telah menentukan bahwa unsur ini mempunyai lima elektron valens dan dapat membentuk tepat dua senyawa berbeda dengan oksigen, mempunyai formula kimia X4O6 and X4O10,
dimana X adalah unsur yang tidak diketahui. apakah unsur yang tidak diketahui ini metal transisi? Mengapa atau mengapa tidak?
dimana X adalah unsur yang tidak diketahui. apakah unsur yang tidak diketahui ini metal transisi? Mengapa atau mengapa tidak?
