Contoh Soal Teori atom Bohr
Contoh Soal Teori atom Bohr - Kegagalan teori atom Rutherford adalah ketidakmampuannya menerangkan elektron yang berputar di sekeliling inti tidak melepaskan energi dalam bentuk radiasi yang mengakibatkan bergabungnya elektron dengan inti. Penyempurnaan teori atom ini dikembangkan oleh Niels Bohr yang menyatakan bahwa elektron memiliki lintasan tertentu selama berputar mengelilingi inti dengan spektrum tertentu pula.


Bagaimana spektrum itu terjadi? Spektrum atom itu terjadi apabila suatu elektron dalam atom memancarkan energi. Spektrum atom selalu mempunyai pola tertentu, ini berarti bahwa elektron dalam suatu atom hanya dapat memancarkan radiasi dengan energi tertentu pula.
Niels Bohr menyatakan bahwa :
- dalam atom, elektron bergerak melalui lintasan dengan tingkat energi tertentu, sehingga elektron itu juga mempunyai tingkat energi tertentu yang dinamakan kulit. Sampai saat ini dikenal 7 kulit yaitu kulit K L M N O P dan Q. Jumlah maksimum elektron yang menempati kulit dirumuskan oleh Pauli 2n2 dengan n = nomor kulit;
- bertentangan dengan teori Maxwell, selama bergerak dalam lintasannya elektron tidak memancarkan energi dalam bentuk radiasi; dan
- elektron dapat menyerap energi dan pindah ke lintasan yang lebih tinggi dan dapat pula melepaskan energi dan pindah ke lintasan yang lebih rendah.
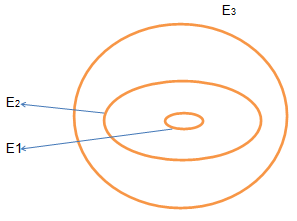
Jadi lintasan elektron dalam atom dapat digambarkan sebagai berikut.
Niels Bohr menyatakan bahwa :
- dalam atom, elektron bergerak melalui lintasan dengan tingkat energi tertentu, sehingga elektron itu juga mempunyai tingkat energi tertentu yang dinamakan kulit. Sampai saat ini dikenal 7 kulit yaitu kulit K L M N O P dan Q. Jumlah maksimum elektron yang menempati kulit dirumuskan oleh Pauli 2n2 dengan n = nomor kulit;
- bertentangan dengan teori Maxwell, selama bergerak dalam lintasannya elektron tidak memancarkan energi dalam bentuk radiasi; dan
- elektron dapat menyerap energi dan pindah ke lintasan yang lebih tinggi dan dapat pula melepaskan energi dan pindah ke lintasan yang lebih rendah.
Jadi lintasan elektron dalam atom dapat digambarkan sebagai berikut.

Apabila lintasan pertama, kedua dan seterusnya merupakan tingkat energi E1, E2 dan seterusnya maka elektron yang pindah dari lintasan kedua ke lintasan pertama akan melepaskan energi sebesar (E2 – E1).

Spektrum Unsur
Niels Bohr mengembangkan teori atom hidrogen dengan mengasumsikan bahwa momentum sudut elektron adalah diskontinu. Jika sinar matahari dilewatkan melalui prisma, maka akan diperoleh spektrum sinar kontinu (tidak putus-putus). Spektrum semacam ini juga disebut spektrum tampak karena tersusun dari warna-warna tampak, dari warna merah sampai warna ungu dengan panjang gelombang 4000 A0 sampai 7000 A0. Spektrum kontinu semacam itu terjadi apabila sinar yang terurai adalah sinar polikromatis (putih). Jika yang dilewatkan melalui prisma adalah gabungan dari sinar monokromatis, maka yang dihasilkan adalah spektrum diskontinu yang hanya terdiri dari atas beberapa warna. Spektrum diskontinu hanya terdiri dari cahaya dengan panjang gelombang tertentu. Suatu unsur tertentu selalu memberikan spektrum garis dengan pola tertentu pula. Tidak ada dua unsur yang memberikan spektrum garis dengan pola yang sama. Pengamatan atas spektrum unsur-unsur ini digunakan oleh Niels Bohr ( 1913 ) untuk menerangkan bagaimana elektron-elektron tersusun dalam atom. Di sisi lain, Max Planck ( 1900 ) mengatakan bahwa energi yang dikandung oleh suatu foton berbanding lurus dengan frekuensi foton itu dan dinyatakan dengan rumus:
Niels Bohr mengembangkan teori atom hidrogen dengan mengasumsikan bahwa momentum sudut elektron adalah diskontinu. Jika sinar matahari dilewatkan melalui prisma, maka akan diperoleh spektrum sinar kontinu (tidak putus-putus). Spektrum semacam ini juga disebut spektrum tampak karena tersusun dari warna-warna tampak, dari warna merah sampai warna ungu dengan panjang gelombang 4000 A0 sampai 7000 A0. Spektrum kontinu semacam itu terjadi apabila sinar yang terurai adalah sinar polikromatis (putih). Jika yang dilewatkan melalui prisma adalah gabungan dari sinar monokromatis, maka yang dihasilkan adalah spektrum diskontinu yang hanya terdiri dari atas beberapa warna. Spektrum diskontinu hanya terdiri dari cahaya dengan panjang gelombang tertentu. Suatu unsur tertentu selalu memberikan spektrum garis dengan pola tertentu pula. Tidak ada dua unsur yang memberikan spektrum garis dengan pola yang sama. Pengamatan atas spektrum unsur-unsur ini digunakan oleh Niels Bohr ( 1913 ) untuk menerangkan bagaimana elektron-elektron tersusun dalam atom. Di sisi lain, Max Planck ( 1900 ) mengatakan bahwa energi yang dikandung oleh suatu foton berbanding lurus dengan frekuensi foton itu dan dinyatakan dengan rumus:

perumusan Max Planck tersebut juga menjadi teori paling fenomenal di kalangan fisikawan di jaman itu.
S1
Kelemahan teori atom Rutherford adalah....
S2
Menurut Niels Bohr, jika elektron beredar mengelilingi inti, maka elektron....
S3
Elektron dapat pindah dari tingkat energi yang rendah ke tingkat energi tinggi dengan cara....
S4
Elektron dapat mengalami transisi yaitu berpindah dari tingkat energi yang tinggi ke tingkat energi rendah dengan cara....
S5
Suatu unsur akan melepaskan energi jika dipanaskan. Bentuk energi yang dilepaskan berupa....
S6
Energi foton (paket kuanta cahaya) akan berbanding lurus dengan frekuensinya. Hal ini dikemukakan oleh....
S7
Jika suatu unsur memancarkan cahaya dengan warna tertentu maka akan diperoleh spektrum....
S8
Elektron akan beredar mengelilingi inti dengan lintasan dan tingkat energi tertentu. Lintasan atau tingkat energi itu dinamakan....
S9
Jumlah tingkat energi elektron adalah....
S10
Jumlah maksimum elektron yang dapat menempati tingkat energi ketiga adalah....
