Contoh Soal Periode pada Tabel Periodik
Contoh Soal Periode pada Tabel Periodik - Tabel Periodik menunjukkan dua tipe pola, yang disebut kelompok dan periode, dalam karakteristik kimia dan fisik unsur. Kelompok didiskusikan secara detil di pelajaran yang lain. Periode diindikasikan oleh baris di Tabel Periodik, dengan membagi baris yang dianggap sebagai satu periode tunggal. Sebagai contoh, unsur lithium (Li) dan beryllium (Be) ditemukan pada periode yang sama dengan boron (B), ckrbon (C), nitrogen (N), oksigen (O), fluorine (F), dan neon (Ne), meskipun terdapat celah diantaranya. Periode dinomori secara berurutan dengan bergerak ke bawah pada tabel; karena hanya satu baris ditemukan di atas contoh sebelumnya, unsur ini dikatakan milik periode kedua. Secara total, tujuh periode terdiri dari semua unsur yang ditemukan di alam.
Sementara unsur dalam periode berbagi shel elektron luar yang sama yang terdiri dari elektron valens, periode yang berbeda mempunyai set shel elektron yang berbeda yang terisi.
Jumlah shel elektron meningkat dan menjadi lebih jauh dari inti atom karena jumlah periode meningkat.

Pola apakah yang jelas antar Periode?
Semua unsur dalan suatu periode terdiri dari jumlah shel elektron yang sama yang mengelilingi inti atomnya. Ini secara These are terisi secara menaik dengan bergerak dari kiri ke kanan di periode, karena jumlah total elektron di setian unsur meningkat satu per satu pada arah ini. Jumlah atom dan jumlah proton juga mengikuti pola ini.
Menariknya, akibat dari setiap proton baru ditambahkan ke inti atom menghasilkan muatan positif yang secara keseluruhan lebih besar di inti. Ini menyebabkan elektron muatan negatif tertarik lebih kuat pada inti, yang menyebabkan pola radius atom menurun seperti pergerakan ke kanan dalam periode.
Ketarikan yang lebih besar membuatnya lebih sulit bagi elektron dalam shel orbit paling luarnya, atau elektron valens, untuk hilang. Jadi energi ionisasi suatu unsur, atau jumlah energi yang dibutuhkan untuk menyebabkan hilangnya suatu elektron, meningkat dengan pergerakan ke kanan dalam tabel.
Secara bersamaan, dalam satu periode pola meningkat yang sama juga terlihat untuk elektronegativiti untuk setiap unsur, yang kecenderungannya menarik elektron ke inti atom. Unsur dengan elektronegatif yang kuat dengan energi ionisasi yang tinggi lebih cenerung untuk mendapatkan elektron untuk menghasilkan anion negatif daripada kehilangan mereka dan menghasilkan cations positif. Karena metal umumnya membentuk cations, unsur yang diakui sebagai non-metal secara umum ditemukan pada sisi kanan periode.
Apa Perbedaan yang Ada pada Periode?
Sementara unsur dalam periode berbagi shel elektron luar yang sama yang terdiri dari elektron valens, periode yang berbeda mempunyai set shel elektron yang berbeda yang terisi.
Jumlah shel elektron meningkat dan menjadi lebih jauh dari inti atom karena jumlah periode meningkat.
Subshel dan Orbit
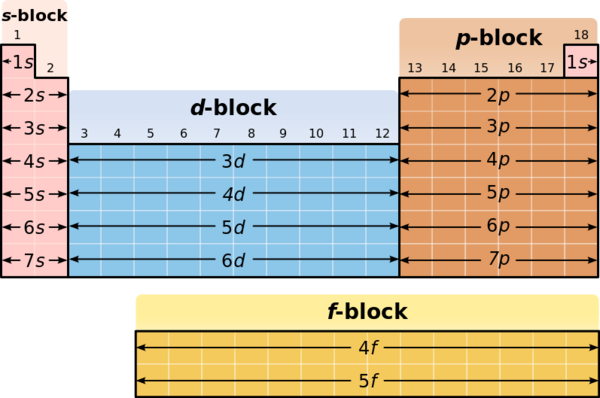
Setiap Periode mempunyai jumlahnya sendiri pada subshel, co Periode 1 hidrogen dan helium, mempunyai 1 shel dengan 1 subshel, 1s. Itu adalah unsur periode pertama, terdiri dari elektron valens yang hanya terdapat pada subshel 1s. Subshel s mempunyai satu orbit, suatu daerah dalam ruangan yang terdiri dari 1 atau 2 elektron.
Unsur
periode ke dua mempunyai jumlah atom dari 3 hingga 10 secara sekuen mengisi ke dua subshel, 2s dan 2p ,
(2p) yang terakhir mempunyai 3 orbit dan dapat menahan hingga enam elektron.
periode ke dua mempunyai jumlah atom dari 3 hingga 10 secara sekuen mengisi ke dua subshel, 2s dan 2p ,
(2p) yang terakhir mempunyai 3 orbit dan dapat menahan hingga enam elektron.
Unsur dinomori dari 11 hingga 18, dari sodium hingga argon, membuat periode ketiga. Shel ke 3 mempunyai 3 subshel 3s, 3p dan 3d, yang terakhir (3d) mempunyai 5 orbit dan dapat menahan hingga 10 elektron. Tetapi pada tahap ini Hukum Oktet berlaku pada shel luar yang menyatakan bahwa shel luar dapat terdiri dari maksimum 8 elektron saja. Jadi Periode ke 3 melihat elektron valens mengisi shel orbit 3s dan 3p.
Periode ke empat, jumlah atom 19 hingga 36, mempunyai empat subshel s, p, d & f, yang terakhir (4f) mempunyai 7 orbit dan dapat menahan 14 elektron. Elektron pertama mengisi 4s, kemudian 3d subshel dan kemudian 4p.
Secara serupa, jumlah atom 37 hingga 54 meliputi periode ke lima,yang mengisi secara sekuensial shell prbit 5s, 4d, dan 5p. Periode ke enam memperluas ke radon di nomor atom 86 dan termasuk lanthanides
(57-71); elektron valens ditemukan pada 6s,
kemudian empat belas eketron tambahan di 4f dengan lanthanides,
diikuti oleh 5d dan 6p.
Terakhir periode ke tujuh
melanjutkan pola ini, termasuk actinides
(89-103), dengan shel orbit 7s, 5f, 6d, dan 7p.
(57-71); elektron valens ditemukan pada 6s,
kemudian empat belas eketron tambahan di 4f dengan lanthanides,
diikuti oleh 5d dan 6p.
Terakhir periode ke tujuh
melanjutkan pola ini, termasuk actinides
(89-103), dengan shel orbit 7s, 5f, 6d, dan 7p.


S1
Apakah elektron valens itu?
S2
Berapakah jumlah maksimum suatu elektron dapat bertahan di subshel d-?
S3
Manakah yang terbaik untuk menggambarkan relasi antara energi ionisasi dan radius atom dalam suatu periode?
S4
Tipe subshel apakah yang secara umum dimiliki oleh periode ke empat hingga ke tujuh?
S5
Diberikan bahwa jumlah atom adalah 15, berapa banyak elektron valens yang dimiliki phosphorus dan milik periode apa?
S6
Unsur mana yang cenderung merupakan yang paling elektronegatif dalam Periode ke 5?
S7
Diberikan jumlah atom thorium adalah 90, subshel mana yang TIDAKterdiri dari elektron untuk unsur ini?
S8
Bergerak dari bromine (Br) ke perak (Ag) dalam Tabel Periodik, subshel mana yang menjadi secara lengkap terisi dengan elektron?
S9
Apakah suatu unsur yang terdiri dari elektron valens di orbit d- paling luar cenderung berupa metal atau
nonmetal? Mengapa demikian?
nonmetal? Mengapa demikian?
S10
Fluorine adalah unsur yang dikenal dengan paling banyak elektronegatif. Diberikan bahwa bentuk yang siap adalah ion -1, mengapa dikatakan bahwa fluorine mempunyai energi ionisasi yang tinggi?
