Contoh Soal Sifat larutan penyangga
Contoh Soal Sifat larutan penyangga - Pada topik sebelumnya kita telah mempelajari tentang topik titrasi asam dan basa. Untuk mengingat kembali topik titrasi asam dan basa, berikut disajikan pengertian titrasi.
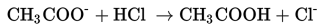
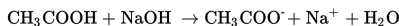
Pengertian Titrasi
Titrasi merupakan salah satu jenis analisa kuantitas untuk menghitung konsentrasi asam atau basa. Pada prinsipnya titrasi merupakan pencampuran antara asam dengan basa, dimana terjadi reaksi netralisasi. Terdapat beberapa macam titrasi, yaitu titrasi antara asam kuat dengan basa lemah dan titrasi basa kuat dengan asam lemah. Selama titrasi berlangsung, akan terjadi hal-hal berikut.
- Larutan hidrolisa pada titik ekivalen
- Larutan penyangga pada titik yang melewati titik ekivalen.
Pada topik ini kita akan mempelajari tentang sifat larutan penyangga/larutan penyangga, termasuk di dalamnya bagaimana pembuatan dan penggunaan larutan penyangga.
- Larutan hidrolisa pada titik ekivalen
- Larutan penyangga pada titik yang melewati titik ekivalen.
Pada topik ini kita akan mempelajari tentang sifat larutan penyangga/larutan penyangga, termasuk di dalamnya bagaimana pembuatan dan penggunaan larutan penyangga.
Pengertian Larutan Penyangga
Larutan penyangga/buffer/dapor adalah larutan yang dapat mempertahankan pH. Larutan penyangga mempunyai pH yang stabil jika dilakukan penambahan sedikit asam atau basa.
Sebagaimana yang telah kita pelajari pada topik kurva titrasi, larutan penyangga terbentuk dari:
a. Titrasi asam kuat dengan basa lemah, dengan penambahan basa lemah sampai melewati titik ekivalen.
Titrasi 50 mL HCl 0,1 M dengan 60 mL NH4OH 0,1 M (Kb= 10-5).
NH4Cl dalam air → NH4+ + Cl-. Dalam larutan penyangga tersebut terdapat sisa basa lemah NH4OH dan asam konjugasinya NH4+. Larutan yang terbentuk merupakan larutan penyangga yang bersifat basa.
Sebagaimana yang telah kita pelajari pada topik kurva titrasi, larutan penyangga terbentuk dari:
a. Titrasi asam kuat dengan basa lemah, dengan penambahan basa lemah sampai melewati titik ekivalen.
Titrasi 50 mL HCl 0,1 M dengan 60 mL NH4OH 0,1 M (Kb= 10-5).
NH4Cl dalam air → NH4+ + Cl-. Dalam larutan penyangga tersebut terdapat sisa basa lemah NH4OH dan asam konjugasinya NH4+. Larutan yang terbentuk merupakan larutan penyangga yang bersifat basa.
b. Titrasi basa kuat dengan asam lemah, dengan penambahan asam lemah sampai melewati titik ekivalen.
Titrasi 50 mL NaOH 0,1 M dititrasi 60 mL asam lemah CH3COOH 0,1 M (Ka = 10-5).
CH3COONa dalam air → CH3COO- + Na+. Dalam larutan penyangga tersebut terdapat sisa asam lemah CH3COOH dan basa konjugasinya CH3COO-. Larutan yang terbentuk merupakan larutan penyangga yang bersifat asam.
Titrasi 50 mL NaOH 0,1 M dititrasi 60 mL asam lemah CH3COOH 0,1 M (Ka = 10-5).
CH3COONa dalam air → CH3COO- + Na+. Dalam larutan penyangga tersebut terdapat sisa asam lemah CH3COOH dan basa konjugasinya CH3COO-. Larutan yang terbentuk merupakan larutan penyangga yang bersifat asam.
Oleh sebab itu dalam larutan penyangga dapat terjadi dari reaksi:
a. sisa basa lemah dengan asam konjugasinya, atau
b. sisa asam lemah dengan basa konjugasinya.
a. sisa basa lemah dengan asam konjugasinya, atau
b. sisa asam lemah dengan basa konjugasinya.
Cara Kerja Larutan Penyangga
Bagaimanakah larutan penyangga dapat mempertahankan pH?. Mari kita perhatikan penjelasan berikut. Secara singkat, cara kerja larutan penyangga adalah ketika asam ditambahkan pada larutan penyangga, asam tersebut akan ternetralisasi oleh basa yang ada di dalamnya. Basa juga akan ternetralisasi oleh asam dari larutan penyangga. Reaksi netralisasi tersebut tidak akan memberikan pengaruh yang banyak terhadap pH larutan. Untuk lebih jelasnya perhatikan contoh berikut
Larutan penyangga asam
Pada larutan penyangga asam, terdapat asam lemah CH3COOH dan basa konjugasinya CH3COO-.
a. Penambahan asam
Jika ke dalam campuran tersebut ditambahkan sedikit asam HCl, akan terjadi reaksi berikut.
Pada larutan penyangga asam, terdapat asam lemah CH3COOH dan basa konjugasinya CH3COO-.
a. Penambahan asam
Jika ke dalam campuran tersebut ditambahkan sedikit asam HCl, akan terjadi reaksi berikut.
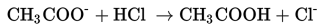
Berdasarkan reaksi ini berarti jumlah basa konjugasinya CH3COO-akan berkurang dan asam lemah CH3COOH akan bertambah. Penambahan asam ke dalam larutan penyangga akan menurunkan konsentrasi basa konjugasi dan meningkatkan konsentrasi asam. Perubahan ini tidak menyebabkan perubahan pH yang besar.
b. Penambahan Basa
Jika kedalam campuran tersebut ditambahkan sedikit basa NaOH, akan terjadi reaksi berikut.
Jika kedalam campuran tersebut ditambahkan sedikit basa NaOH, akan terjadi reaksi berikut.
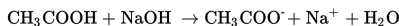
Berdasarkan reaksi tersebut, berarti jumlah asam lemah CH3COOH akan berkurang dan basa konjugasinya ion CH3COO- akan bertambah. Perubahan ini tidak menyebabkan perubahan pH yang besar.
c. Penambahan air (pengenceran)
Derajat keasaman atau pH suatu larutan penyangga ditentukan oleh komponen -komponennya. Jika suatu campuran tersebut diencerkan maka harga perbandingan komponen-komponen tersebut tidak berubah sehingga pH larutan penyangga juga praktis tidak berubah.
c. Penambahan air (pengenceran)
Derajat keasaman atau pH suatu larutan penyangga ditentukan oleh komponen -komponennya. Jika suatu campuran tersebut diencerkan maka harga perbandingan komponen-komponen tersebut tidak berubah sehingga pH larutan penyangga juga praktis tidak berubah.
Fungsi Larutan Penyangga
Dalam Darah
Darah juga mengandung sistem penyangga yaitu H2CO3 dengan HCO3-. Kebutuhan larutan penyangga dalam darah dikarenakan hal-hal berikut ini.
a. pH darah umumnya sekitar 7,4.
b. Jika pH darah selisih 0,5 saja, akan menyebabkan ketidaksadaran atau kondisi koma.
c. Karbondioksida yang dihasilkan melalui pernapasan dapat meningkatkan keasaman darah dengan membentuk ion H+.
d. Kehadiran ion hidrogen karbonat akan menghilangkan H+ yang berlebihan.
Darah juga mengandung sistem penyangga yaitu H2CO3 dengan HCO3-. Kebutuhan larutan penyangga dalam darah dikarenakan hal-hal berikut ini.
a. pH darah umumnya sekitar 7,4.
b. Jika pH darah selisih 0,5 saja, akan menyebabkan ketidaksadaran atau kondisi koma.
c. Karbondioksida yang dihasilkan melalui pernapasan dapat meningkatkan keasaman darah dengan membentuk ion H+.
d. Kehadiran ion hidrogen karbonat akan menghilangkan H+ yang berlebihan.
Dalam haemoglobin darah terdapat larutan penyangga HHb2+ dengan HbO2-.
Aplikasi larutan penyangga yang lain
Beberapa peralatan rumah tangga menggunakan cara kerja larutan penyangga.
a. Pada shampoo, larutan penyangga digunakan untuk menjaga kebasaan supaya tidak mencederai mata.
b. Pada lotion bayi, menjaga pH supaya tetap 6 untuk mencegah perkembangbiakan bakteri.
c. Selain itu, sistem penyangga juga ditemukan pada tetes mata dan serbuk pencuci.
Beberapa peralatan rumah tangga menggunakan cara kerja larutan penyangga.
a. Pada shampoo, larutan penyangga digunakan untuk menjaga kebasaan supaya tidak mencederai mata.
b. Pada lotion bayi, menjaga pH supaya tetap 6 untuk mencegah perkembangbiakan bakteri.
c. Selain itu, sistem penyangga juga ditemukan pada tetes mata dan serbuk pencuci.
S1
Pada reaksi asam kuat dengan basa lemah yang berlebih, akan terbentuk larutan penyangga yang bersifat ....
S2
Larutan penyangga terbentuk dari reaksi ....
S3
Jika suatu larutan penyangga asam ditambahkan sedikit asam, maka perubahan yang terjadi di dalam larutan tersebut adalah ....
S4
Salah satu kegunaan larutan penyangga adalah menyeimbangkan pH cairan intrasel. Larutan penyangga yang dimaksud adalah ....
S5
Jika 20 mL NH4OH 0,001 M (Kb =10-5) bereaksi dengan 20 mL NH4+ 0,002 M, maka pH larutan yang terbentuk adalah ....
S6
Asam lemah (Kb = 10-5) bereaksi dengan basa konjugasi 5 mol. Jumlah mol asam lemah tersebut yang dibutuhkan untuk membentuk larutan penyangga dengan pH = 6 adalah ....
S7
Perbandingan antara konsentrasi NH4OH (Kb = 10-6) dan NH4+ dalam larutan penyangga yang mempunyai pH = 8 adalah ....
S8
Reaksi antara V ml CH3COOH 0,1 M dengan 10 mL NaOH 0,2 M, akan menghasilkan larutan penyangga. Nilai V yang tepat agar terbentuk larutan penyangga asam adalah ....
S9
Reaksi berikut ini yang dapat membentuk larutan penyangga adalah ....
S10
Jika perbandingan mol asam lemah dengan basa konjugasinya adalah 2 : 1, maka nilai tetapan asam (Ka) pada larutan penyangga dengan pH = 4 adalah ....
