Contoh Soal Energi Aktivasi - Memulai Sebuah Reaksi
Contoh Soal Energi Aktivasi - Memulai Sebuah Reaksi - Rantai kimia dapat menjadi rusak dan dibentuk dengan melakukan transfer atau membagikan elektron. Mereka membutuhkan penyerapan atau pelepasan energi. Semua molekul memiliki sejumlah energi kinetik dan potensial. Energi kinetik memungkinkan mereka bergerak bebas dan saling bertumbukan satu sama lain, sementara energi potensial disimpan dalam jaringan mereka. Semakin cepat molekul bergerak, semakin besar pula peluang terjadinya tumbukan. Tumbukan bertanggung jawab untuk membuat dan memecah jaringan. Dengan hanya memiliki jumlah tumbukan yang besar tidak akan mengakibatkan terjadinya reaksi. Molekul harus berorientasi dengan tepat agar reaksi dapat terjadi. Dengan kata lain, jika molekul bertumbukan satu sama lain pada sudut yang kurang tepat maka jaringan tidak akan terpecah maupun terbentuk.
O 2 ( g ) + N O ( g ) → C l N 2 O 3 → N O 2 ( g ) + C l N O ( g )
e − ( E a / R T ) 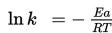
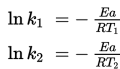
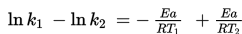
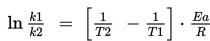
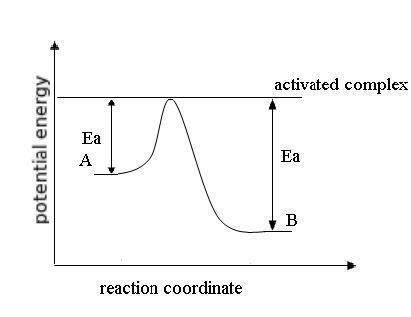
Batasan energi minimum yang harus dimiliki sebuah reaksi kimia untuk dapat terjadi disebut dengan energi aktivasi (Ea). Energi ini biasanya ditulis dengan kilojoule per mol. Semakin besar energi aktivasi, semakin lama waktu yang dibutuhkan sebuah reaksi untuk berakhir dan semakin sulit reaksi dimulai. Ea adalah perbedaan energi antara reaktan dan kondisi transisi. Kondisi transisi adalah bagian reaksi yang memiliki energi terbesar. Contoh reaksi:
Kompleks yang diaktifkan adalah ClN2O3. Ini adalah molekul tidak stabil yang cukup tinggi. Kompleks ini akan segera terpecah menjadi produk NO2(g) dan ClNO(g).
Kompleks yang diaktifkan memiliki energi tertinggi pada diagram energi.
Katalisator mengurangi energi aktivasi dengan mengatur molekul dengan tepat sehingga mereka dapat membentuk jaringan dengan lebih mudah. Katalisator juga meningkatkan laju reaksi dan memungkinkan reaksi untuk terjadi lebih cepat. Mereka tidak habis digunakan dalam reaksi. Anda tidak perlu menambahkan banyak katalisator untuk menghasilkan dampak besar dari reaksi Anda.
Katalisator tidak mempengaruhi konstanta ekuilibrium reaksi. Dengan kata lain, zat ini tidak merubah hubungan antara produk dengan reaktan.
Selain katalisator, hal lain yang mempunyai efek pada laju reaksi adalah temperatur. Ketika temperatur substansi meningkat, kecepatan partikel individual pun juga meningkat. Sehingga, ketika temperatur meningkat, energi kinetik juga meningkat. Seiring dengan meningkatnya energi kinetik, pemisahan molekul yang mempunyai energi kinetik cukup tinggi untuk membentuk energi aktivasi untuk reaksi juga meningkat.
Pemisahan molekul yang memiliki energi sama atau lebih besar daripada Ea dilakukan oleh aturan eksponensial e-(Ea/RT) dalam persamaan Arrhenius:
- k adalah rerata konstanta
- Ea adalahenergi aktivasi
- R adalah konstanta gas
- T adalah temperatur dalam Kelvin
- A adalah faktor Arrhenius. Ini mengindikasikan rerata tumbukan dan pemisahan tumbukan dengan orientasi terbaik untuk terjadinya reaksi. Kita menghilangkan faktor ini atau menuliskannya sebagai "1" karena kita biasanya mengikutsertakan faktor ini bahkan ketika menuliskan Ea . A selalu diberikan dalam syarat M-1s-1, dimana M = Molaritas dan s = sekon
Anda dapat menghitungnya ketika terdapat dua temperatur tidak diketahui dan sebuah rerata konstanta pada tiap temperatur. Ln berada pada satu sisi sehingga:
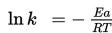
Jadi,
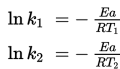
Mengurangi dua persamaan:
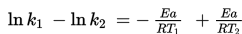
jadi,
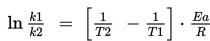
Grafik berikut ini menerangkan konsep energi aktivasi dalam reaksi reversibel:

S1
Manakah pernyataan berikut yang salah?
S2
Manakah pertanyaan berikut yang salah?
S3
Manakah pernyataan yang salah tentang energi aktivasi?
S4
Manakah pernyataan yang tepat berikut ini?
I Katalisator mengurangi energi aktivasi dengan mengatur molekul dengan tepat agar dapat membentuk ikatan dengan mudah.
II Katalisator juga meningkatkan laju reaksi dan memungkinkan reaksi terjadi lebih cepat.
III Meningkatkan temperatur mengurangi energi aktifasi.
IV Peningkatan temperatur menghasilkan energi kinetik total reaksi.
V Molekul cepat akan bereaksi lebih cepat.
S5
Manakah pernyataan yang salah tentang katalisator?
S6
Sebuah reaksi memiliki rerata konstanta 11 M-1s-1 pada 345 K dan sebuah faktor Arrhenius 20M-1s-1. Berapakah energi aktifasinya?
S7
Seorang guru mengamati sebuah reaksi yang rerata konstantanya meningkat ketika temperatur berubah dari 273 K menjadi 580 K. Berapakah energi aktifasi reaksi ini?
S8
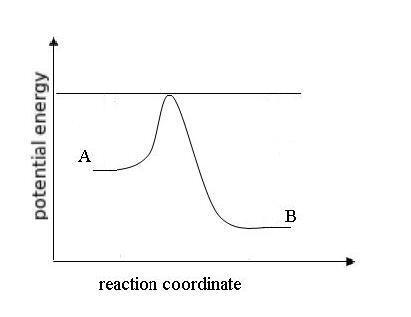
Lihatlah reaksi reversibel pada grafik.

Reaksi manakah yang mempunyai energi aktivasi lebih tinggi?
S9
Jika energi aktifasi sebuah reaksi (Ea1) lebih tinggi daripada energi aktifasi reaksi kedua (Ea2).
Reaksi manakah yang terjadi lebih mudah?
S10
Komplek yang diaktifkan ______________.:
