Contoh Soal Laju Reaksi dan Teori Tumbukan
Contoh Soal Laju Reaksi dan Teori Tumbukan - Kecepatan yang digunakan reaktan untuk berubah menjadi produk disebut dengan laju reaksi.
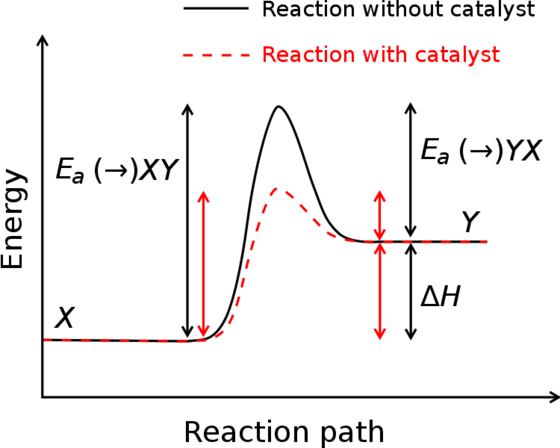
Agar sebuah reaksi dapat terjadi maka partikel reaktan harus bertumbukan dengan energi yang cukup sehingga reaksi berhasil terjadi, energi ini disebut energi Aktivasi.
Teori Tumbukan dapat digunakan untuk menjelaskan laju reaksi kimia.

Berdasarkan teori tumbukan
- Agar sebuah reaksi kimia dapat terjadi, maka partikel reaktan harus bertumbukan satu sama lain.
- Tidak semua tumbukan dapat menghasilkan pembentukan produk.
Hanya beberapa dari tumbukanlah yang dapat menyebabkan reaksi kimia. Tumbukan semacam ini disebut dengan "tumbukan yang berhasil". - Agar reaksi dapat terjadi, maka partikel reaktan harus bertumbukan dengan energi minimum yang disebut energi aktivasi Ea.
- Energi aktivasi pada umumnya lebih tinggi daripada partikel reaktan dalam kondisi normal. Hanya tumbukan yang memiliki energi yang sama atau lebih besar dari energi aktivasi akan menghasilkan pembentukan produk.
- Jika terdapat banyak tumbukan yang berhasil terjadi per satuan waktu, maka reaksi akan berlangsung lebih cepat.
- Laju reaksi berbanding secara langsung dengan frekuensi dari tumbukan yang berhasil.
Sejumlah faktor yang mempengaruhi laju reaksi yaitu:.
Temperatur/ Suhu
Jika temperatur/ suhu sebuah reaksi mengalami peningkatan, maka energi kinetik dalam partikel juga akan meningkat. Hal ini menyebabkan partikel dapat bergerak lebih leluasa sehingga jumlah tumbukan yang berhasil mengalami peningkatan, demikian pula dengan laju reaksi. Baik pada reaksi eksotermis maupun endotermis, laju reaksi akan meningkat bersama dengan temperatur. Pada semua reaksi kimia, laju reaksi akan meningkat pada saat temperatur mengalami peningkatan per 10⁰C.
Konsentrasi
Jika konsentrasi reaktan dalam sebuah larutan mengalami peningkatan, maka terdapat jumlah partikel reaktan yang lebih besar tiap satuan volume dan memungkinkan bertambahnya jumlah tumbukan yang berhasil , sehingga meningkatkan laju reaksi.
Tekanan
Meskipun meningkatan tekanan pada sebuah reaksi hanya dapat dilakukan pada zat padat sedangkan peningkatan tekanan pada zat cair tidak berpengaruh pada laju reaksi, namun meningkatkan tekanan pada reaktan yang berwujud gas dapat mempercepat laju reaksi. Tekanan dapat ditingkatkan dengan menambahkan reaktan berwujud gas atau dengan menggunakan bejana reaktan yang lebih kecil. Hal ini akan meningkatkan jumlah tumbukan yang berhasil, dan dengan sendirinya meningkatkan kecepatan laju reaksi.
Percampuran
Jika sejumlah reaktan dicampurkan, mereka berada dalam kondisi bergerak sehingga meningkatkan jumlah tumbukan yang berhasil dan dengan demikian meningkatkan laju reaksi.
Areal Permukaan
JIka reaktan berupa benda padat dihaluskan, maka reaksi akan lebih cepat terjadi dibandingkan pada reaktan padat yang berwujud irisan atau gumpalan. Dengan dihaluskan maka areal permukaan reaktan juga akan mengalami peningkatan. Banyaknya jumlah reaktan yang saling terkait satu sama lain dengan sendirinya meningkatkan peluang terjadinya tumbukan yang berhasil dan laju reaksi. Sama halnya dengan katalisator padat yang diubah dalam bentuk bubuk pada saat digunakan untuk sebuah reaksi kimia.
Orientasi reaktan
Partikel reaktan harus berada pada orientasi spasial yang tepat serta dianjurkan guna memutuskan rantai reaksi. Semakin besar kemungkinan terjadinya tumbukan antara reaktan dengan orientasi yang dibutuhkan, semakin besar peluang terjadinya tumbukan yang berhasil dan mempercepat terjadinya laju reaksi.
Katalisator
Katalisator adalah sebuah substansi yang meningkatkan kecepatan pada reaksi kimia, namun zat itu sendiri tidak mengalami perubahan. Hal ini juga meningkatkan jumlah tumbukan efektif diantara reaktan, yakni dengan menurunkan energi aktivasi atau mengubah orientasi pada reaktan.
S1
Apakah yang terjadi jika temperatur sebuah reaksi kimia mengalami peningkatan?
- Rerata energi kinetik pada partikel meningkat
- Rerata energi potensial pada partikel meningkat
- Jumlah tumbukan yang berhasil meningkat
- Tidak ada perubahan pada frekuensi tumbukan yang berhasil
S2
Jika reaktan padat dihaluskan, maka reaksi yang dihasilkan menjadi lebih cepat. Apakah alasannya?
S3
Sesuai dengan teori tumbukan, manakah pernyataan di bawah ini yang terjadi pada sebuah reaksi kimia?
S4
Manakah pernyataan yang tepat mengenai katalisator?
S5
10g tembaga dan 150ml asam sulfur telah dicampurkan. Manakah kombinasi yang tepat untuk menghasilkan reaksi paling cepat?
S6
Sebuah reaksi kimia terjadi antara 5g seng dan 100 ml dari 0,5M asam hidroklorida. Apabila air ditambahkan maka konsentrasi asam hidroklorida akan berkurang hingga 0,1M, demikian pula laju reaksi akan mengalami penurunan. Mengapa demikian?
S7
NaOH(aq) + HNO3(aq) → NaNO3(aq) + H2O(l)
Manakah kondisi di bawah ini yang akan menurunkan laju reaksi di atas?
S8
7g pita magnesium bereaksi terhadap 150ml dari 0.7M HCl(aq) pada 25⁰C. Manakah kondisi di bawah ini yang akan meningkatkan laju reaksi?
S9
Manakah dari kondisi di bawah ini yang mempengaruhi laju reaksi, Ni(s) + H2SO4(aq) → NiSO4(aq) + H2(g)
S10
25g keping seng bereaksi dengan 200ml asam hidroklorida pada dua eksperimen yang berbeda.
Reaksinya adalah Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g) . Pada eksperimen pertama reaksi berlangsung selama 5 menit, sedangkan pada eksperimen kedua reaksi berlangsung selama 9 menit. Kondisi apakah yang mungkin terjadi pada eksperimen kedua dengan waktu lebih lama untuk bereaksi?
