Contoh Soal Sifat-Sifat Fisik Unsur Periode Ketiga
Contoh Soal Sifat-Sifat Fisik Unsur Periode Ketiga - Unsur-unsur periode ketiga terdiri dari natrium, magnesium dan alumunium (logam), silikon (metaloid) dan fosforus, sulfur, klorin, dan argon (nonlogam). Unsur-unsur yang terletak pada periode yang sama, memiliki jumlah elektron valensi yang berbeda. Unsur-unsur periode ketiga ini menunjukkan perubahan sifat secara beraturan. Perhatikan tabel berikut ini.
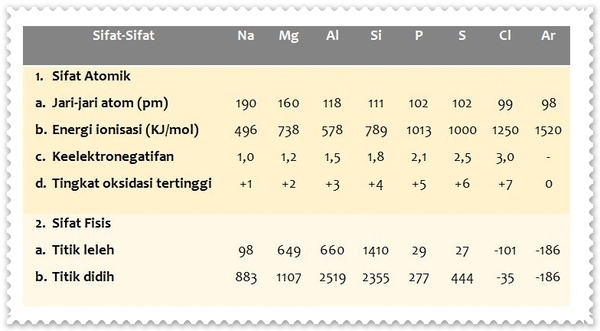

Sifat-sifat fisik unsur periode ketiga sebagai berikut.
1. Wujud pada suhu ruangan
Berdasarkan data titik leleh dan titik didih, dapat disimpulkan bahwa unsur-unsur natrium, magnesium, alumunium, silikon, fosfor, dan belerang berwujud padat. Sementara klor dan argon berwujud gas.
2. Titik leleh dan titik didih
Berdasarkan data pada tabel terlihat bahwa titik leleh dan titik didih unsur periode ketiga, secara berurutan natrium – magnesium – alumunium - silikon semakin besar. Akan tetapi secara berurutan fosfor – belerang – klorin – argon semakin kecil. Silikon memiliki titik leleh dan titik didih tertinggi karena silikon mempunyai struktur kovalen raksasa dimana setiap atom silikon terikat secara kovalen pada empat atom silikon lainnya.
3. Jari-jari atom
Pertambahan nomor atom dalam suatu periode mengakibatkan muatan inti bertambah, sehingga elektron-elektron valensi tertarik semakin kuat ke inti atom. Akibatnya, jari-jari atom mulai dari kiri ke kanan (natrium – magnesium – alumunium – silikon - fosfor – belerang – klorin – argon ) semakin kecil.
4. Keelektronegatifan
Peningkatan keelektronegatifan disebabkan oleh penguatan gaya tarik inti seiring dengan bertambahnya nomor atom. Akibatnya, keelektronegatifan atom mulai dari kiri ke kanan (natrium – magnesium – alumunium – silikon - fosfor – belerang – klorin – argon ) semakin besar.
5. Energi ionisasi
Peningkatan energi ionisasi disebabkan oleh penguatan gaya tarik inti seiring dengan bertambahnya nomor atom. Hal ini berarti bahwa atom semakin sulit untuk melepas elektronnya dan membentuk ion positif. Pada umumnya, energi ionisasi dari natrium ke argon semakin besar. Akan tetapi, energi ionisasi Mg lebih besar daripada Al dan energi ionisasi P lebih besar daripada S. Hal ini disebabkan oleh susunan elektron dalam orbital yang penuh atau setengah penuh memiliki kestabilan yang lebih besar.
6. Sifat logam
Pada umumnya, sifat logam unsur periode ketiga dari kiri ke kanan semakin kecil atau semakin berkurang. Unsur natrium, magnesium, dan alumunium merupakan unsur logam. Sifat daya hantar listrik (konduktor) logam tersebut secara berurutan natrium – magnesium – alumunium semakin meningkat. Silikon merupakan semilogam (metaloid) yang bersifat semikonduktor. Sementara fosfor, belerang, dan klor merupakan nonlogam yang tidak menghantarkan arus listrik.
1. Wujud pada suhu ruangan
Berdasarkan data titik leleh dan titik didih, dapat disimpulkan bahwa unsur-unsur natrium, magnesium, alumunium, silikon, fosfor, dan belerang berwujud padat. Sementara klor dan argon berwujud gas.
2. Titik leleh dan titik didih
Berdasarkan data pada tabel terlihat bahwa titik leleh dan titik didih unsur periode ketiga, secara berurutan natrium – magnesium – alumunium - silikon semakin besar. Akan tetapi secara berurutan fosfor – belerang – klorin – argon semakin kecil. Silikon memiliki titik leleh dan titik didih tertinggi karena silikon mempunyai struktur kovalen raksasa dimana setiap atom silikon terikat secara kovalen pada empat atom silikon lainnya.
3. Jari-jari atom
Pertambahan nomor atom dalam suatu periode mengakibatkan muatan inti bertambah, sehingga elektron-elektron valensi tertarik semakin kuat ke inti atom. Akibatnya, jari-jari atom mulai dari kiri ke kanan (natrium – magnesium – alumunium – silikon - fosfor – belerang – klorin – argon ) semakin kecil.
4. Keelektronegatifan
Peningkatan keelektronegatifan disebabkan oleh penguatan gaya tarik inti seiring dengan bertambahnya nomor atom. Akibatnya, keelektronegatifan atom mulai dari kiri ke kanan (natrium – magnesium – alumunium – silikon - fosfor – belerang – klorin – argon ) semakin besar.
5. Energi ionisasi
Peningkatan energi ionisasi disebabkan oleh penguatan gaya tarik inti seiring dengan bertambahnya nomor atom. Hal ini berarti bahwa atom semakin sulit untuk melepas elektronnya dan membentuk ion positif. Pada umumnya, energi ionisasi dari natrium ke argon semakin besar. Akan tetapi, energi ionisasi Mg lebih besar daripada Al dan energi ionisasi P lebih besar daripada S. Hal ini disebabkan oleh susunan elektron dalam orbital yang penuh atau setengah penuh memiliki kestabilan yang lebih besar.
6. Sifat logam
Pada umumnya, sifat logam unsur periode ketiga dari kiri ke kanan semakin kecil atau semakin berkurang. Unsur natrium, magnesium, dan alumunium merupakan unsur logam. Sifat daya hantar listrik (konduktor) logam tersebut secara berurutan natrium – magnesium – alumunium semakin meningkat. Silikon merupakan semilogam (metaloid) yang bersifat semikonduktor. Sementara fosfor, belerang, dan klor merupakan nonlogam yang tidak menghantarkan arus listrik.
S1
Berikut ini yang merupakan unsur nonlogam pada periode ketiga dalam sistem periodik unsur adalah ....
S2
Di antara unsur-unsur berikut, yang memiliki jari-jari atom terbesar adalah ....
S3
Unsur belerang memiliki nomor atom 16 dapat membentuk ion S2-. Berikut ini yang merupakan konfigurasi elektron terluar dari ion S2- adalah ....
S4
Di antara unsur-unsur berikut, unsur yang memiliki energi ionisasi terbesar adalah ....
S5
Unsur periode ketiga yang tergolong semilogam (metaloid) adalah ....
S6
Unsur yang memiliki tingkat oksidasi tertinggi pada periode ketiga adalah ...
S7
Keelektronegatifan dari beberapa unsur periode ketiga dapat dilihat pada tabel berikut.
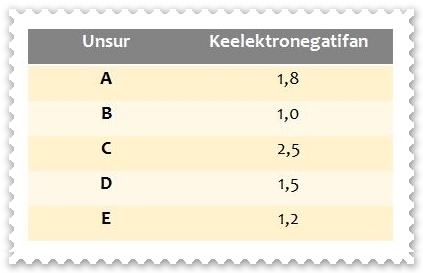
Urutan keelektronegatifan unsur yang benar dari kiri ke kanan adalah ....

Urutan keelektronegatifan unsur yang benar dari kiri ke kanan adalah ....
S8
Bilangan oksidasi P dalam senyawa H₃PO₄ adalah ....
S9
Unsur periode ketiga yang paling banyak ditemukan di alam adalah ....
S10
Unsur periode ketiga yang memiliki titik didih dan titik leleh tertinggi adalah ....
