Contoh Soal Bilangan Kuantum
Contoh Soal Bilangan Kuantum - Bilangan kuantum adalah bilangan yang menunjukkan orbit elektron selama mengelilingi inti pada kulit tertentu. Bilangan ini juga menentukan jumlah elektron yang mengelilingi inti atom.
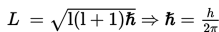
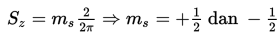
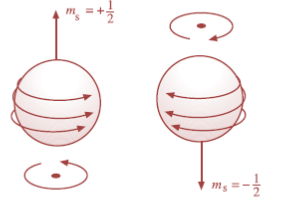
Terdapat empat bilangan kuantum dalam orbit elektron, yaitu sebagai berikut.
1. Bilangan Kuantum Utama (n)
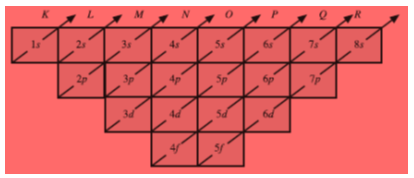
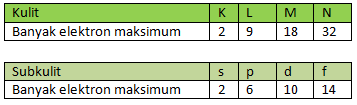
Bilangan kuantum utama (n) menunjukkan besar lintasan elektron. Bilangan ini memiliki nilai 1, 2, 3, 4, 5, dst. Kulit yang bersesuaian dengan n dinyatakan dengan huruf K, L, M, N, dst.
2. Bilangan Kuantum Orbital atau Azimuth (ℓ)
Bilangan kuantum orbital menunjukkan di subkulit (sublintasan) mana elektron itu bergerak. Rinciannya berdasarkan momentum sudut. Bilangan kuantum ini dapat bernilai 0, 1, 2, 3, ... (n – 1).
Subkulit ℓ = 0 disebut subkulit s (sharp)
Subkulit ℓ = 1 disebut subkulit p (principle)
Subkulit ℓ = 2 disebut subkulit d (difusse)
Subkulit ℓ = 3 disebut subkulit f (fundamental)
Subkulit ℓ = 1 disebut subkulit p (principle)
Subkulit ℓ = 2 disebut subkulit d (difusse)
Subkulit ℓ = 3 disebut subkulit f (fundamental)
Untuk menentukan jumlah subkulit atau mengetahui keadaan atomik pada suatu kulit dapat menggunakan diagram berikut ini.

Gambar Diagram untuk menentukan jumlah subkulit pada suatu kulit atom.
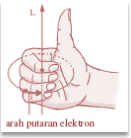
Arah momentum sudut elektron tegak lurus dengan bidang orbit elektron. Jika arah orbit elektron diketahui, arah momentum sudutnya dapat ditentukan dengan kaidah tangan kanan seperti berikut

Momentum sudut elektron dirumuskan sebagai berikut.
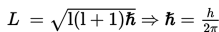
Keterangan:
L = momentum sudut (Js);
ℓ = bilangan kuantum orbital (tanpa satuan); dan
h = tetapan Planck.
L = momentum sudut (Js);
ℓ = bilangan kuantum orbital (tanpa satuan); dan
h = tetapan Planck.
3. Bilangan Kuantum Magnetik (mℓ)
Bilangan kuantum magnetik digunakan untuk menentukan orientasi dari orbit elektron dalam medan magnet. Bilangan kuantum magnetik memiliki nilai –ℓ, –ℓ + 1, ..., 0, ..., ℓ – 1, ℓ.
Untuk nilai ℓ tertentu, nilai mℓ dapat ditentukan sebagai berikut.
Untuk nilai ℓ tertentu, nilai mℓ dapat ditentukan sebagai berikut.
ℓ = 0 maka mℓ = 0
ℓ = 1 maka mℓ = –1, 0, + 1
ℓ = 2 maka mℓ = –2, –1, 0, + 1, +2, dan seterusnya.
ℓ = 1 maka mℓ = –1, 0, + 1
ℓ = 2 maka mℓ = –2, –1, 0, + 1, +2, dan seterusnya.
4. Bilangan Kuantum Spin (ms)
Bilangan kuantum spin memberikan gambaran tentang arah putaran elektron pada sumbunya sendiri. Bilangan kuantum ini memiliki harga dan . Dengan demikian, momentum anguler spin elektron dirumuskan sebagai berikut.
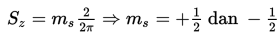
Banyak elektron maksimum yang menempati setiap kulit atau subkulit adalah sebagai berikut.

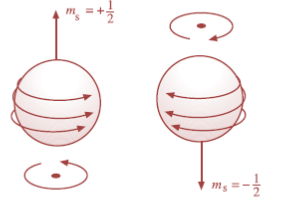
Gambar Spin elektron
Dalam atom, tidak mungkin dua buah elektron mempunyai empat bilangan kuantum yang sama. Prinsip tersebut dinyatakan dalam asas larangan Pauli berikut.
Dalam atom, tidak mungkin dua buah elektron mempunyai empat bilangan kuantum yang sama. Prinsip tersebut dinyatakan dalam asas larangan Pauli berikut.
Tidak mungkin terdapat dua elektron dalam suatu atom yang memiliki keadaan kuantum yang sama.
Maksudnya, dua buah elektron dalam sebuah atom tidak mungkin mempunyai keempat bilangan kuantum (n, ℓ, m, ms) yang tepat sama, setidaknya pasti ada satu bilangan kuantum yang berbeda.
SOAL 1
Bilangan yang menentukan jari-jari lintasan dan tingkat energi elektron pada atom adalah ....
SOAL 2
Bilangan kuantum yang memiliki nilai 0, 1, 2, 3, ..., (n – 1) adalah ....
SOAL 3
Momentum sudut yang dimiliki oleh elektron saat bergerak dalam lintasan dapat ditentukan dengan rumus ....
SOAL 4
Jika diketahui tetapan Planck h = 6,63 × 10–34 Js, maka momentum sudut elektron untuk bilangan kuantum orbital, ℓ = 3 adalah ....
SOAL 5
Elektron yang menempati kulit N dan subkulit d memiliki momentum sudut sebesar ....
SOAL 6
Untuk menentukan arah momentum dapat digunakan dengan menggunakan kaidah tangan kanan, yaitu ....
SOAL 7
Jika elektron berputar atau berotasi ke kanan maka arah bilangan kuantum spin akan menunjuk ke arah ....
SOAL 8
Jumlah maksimum elektron yang dapat ditempati pada kulit L adalah ... buah.
SOAL 9
Nomor atom kalsium adalah 20. Konfigurasi elektron untuk Ca adalah ....
SOAL 10
Tidak mungkin dua elektron dalam satu atom memiliki bilangan kuantum yang sama.
Pernyataan di atas merupakan prinsip yang dikemukakan oleh ....
