Contoh Soal Titrasi asam basa
Contoh Soal Titrasi asam basa - Indikator merupakan suatu zat/bahan yang digunakan untuk mengetahui sifat asam atau basa suatu larutan. Indikator terdiri dari indikator alami dan indikator buatan.

Indikator buatan mempunyai kelebihan dalam menentukan rentang pH suatu larutan asam atau basa. pH suatu larutan dapat kita hitung menggunakan konsentrasi H+ atau OH- yang dimiliki oleh larutan tersebut.
Dalam topik ini, kalian akan mempelajari tentang titrasi asam dan basa.
Dalam topik ini, kalian akan mempelajari tentang titrasi asam dan basa.
1. Pengertian Titrasi
Titrasi merupakan metode kimia yang dapat digunakan untuk mengetahui konsentrasi H+ atau OH- yang dimiliki oleh suatu asam atau basa.
Pada prinsipnya, titrasi merupakan pencampuran antara asam dengan basa, dimana terjadi reaksi netralisasi. Reaksi netralisasi ini, terjadi antara ion hidrogen sebagai asam dengan ion hidroksida sebagai basa kemudian membentuk air yang bersifat netral, sehingga titrasi disebut juga dengan reaksi netralisasi.
Pada prinsipnya, titrasi merupakan pencampuran antara asam dengan basa, dimana terjadi reaksi netralisasi. Reaksi netralisasi ini, terjadi antara ion hidrogen sebagai asam dengan ion hidroksida sebagai basa kemudian membentuk air yang bersifat netral, sehingga titrasi disebut juga dengan reaksi netralisasi.
2. Istilah dalam Titrasi
Dalam titrasi, kita mengenal beberapa hal seperti berikut.
a. Larutan standar disebut juga titran/titer yaitu larutan yang telah diketahui konsentrasinya.
b. Titrat disebut juga analit yaitu larutan yang akan dicari konsentrasinya. Pada pelaksanaan titrasi, titran harus ditetapkan terlebih dahulu volumenya.
c. Asidimetri adalah metode titrasi yang digunakan untuk menganalisis sampel yang bersifat basa. Bila titrannya berupa zat basa, maka kita dapat menggunakan larutan standar berupa asam.
d. Alkalimetri adalah metode titrasi yang digunakan untuk menganalisa sampel yang bersifat asam,sehingga larutan standarnya harus bersifat basa.
e. Titik ekivalen disebut juga titik akhir titrasi dimana jumlah mol ekivalen asam sama dengan mol ekivalen basa. Dalam melakukan titrasi netralisasi, kita perlu secara cermat mengamati perubahan pH, khususnya pada saat akan mencapai titik akhir titrasi. Titik akhir titrasi dapat diamati dari perubahan warna titran yang bersifat tetap.
Perubahan warna pada titik ekivalen dapat terjadi karena adanya reaksi antara indikator dan titran. Perubahan warna inilah sebagai tanda bahwa titik ekivalen telah terlewati dan titrasi harus dihentikan. Indikator yang digunakan dalam titrasi asam basa ini haruslah sesuai rentang pH pada titik ekivalen agar perubahan dapat jelas teramati.
a. Larutan standar disebut juga titran/titer yaitu larutan yang telah diketahui konsentrasinya.
b. Titrat disebut juga analit yaitu larutan yang akan dicari konsentrasinya. Pada pelaksanaan titrasi, titran harus ditetapkan terlebih dahulu volumenya.
c. Asidimetri adalah metode titrasi yang digunakan untuk menganalisis sampel yang bersifat basa. Bila titrannya berupa zat basa, maka kita dapat menggunakan larutan standar berupa asam.
d. Alkalimetri adalah metode titrasi yang digunakan untuk menganalisa sampel yang bersifat asam,sehingga larutan standarnya harus bersifat basa.
e. Titik ekivalen disebut juga titik akhir titrasi dimana jumlah mol ekivalen asam sama dengan mol ekivalen basa. Dalam melakukan titrasi netralisasi, kita perlu secara cermat mengamati perubahan pH, khususnya pada saat akan mencapai titik akhir titrasi. Titik akhir titrasi dapat diamati dari perubahan warna titran yang bersifat tetap.
Perubahan warna pada titik ekivalen dapat terjadi karena adanya reaksi antara indikator dan titran. Perubahan warna inilah sebagai tanda bahwa titik ekivalen telah terlewati dan titrasi harus dihentikan. Indikator yang digunakan dalam titrasi asam basa ini haruslah sesuai rentang pH pada titik ekivalen agar perubahan dapat jelas teramati.
3. Pelaksanaan Titrasi
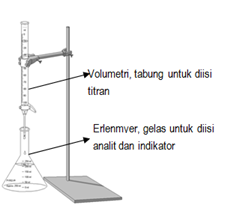
Titrasi dilakukan dengan menyusun alat seperti gambar.
Berikut langkah-langkah melakukan titrasi asam basa.
1. Siapkan larutan yang akan ditentukan molaritasnya.
2. Pilih indikator berdasarkan trayek pH dan perubahan warna indikator untuk memudahkan pengamatan. Tambahkan beberapa tetes pada larutan.
3. Tambahkan zat penitrasi setetes demi setetes dengan selalu menggoyangkan erlenmeyer agar terjadi reaksi sempurna.
4. Ketika mendekati titik ekuivalen, penambahan zat penetrasi dilakukan dengan sangat hati-hati. Buka kran buret, peniter yang keluar jangan sampai menetes, tetapi ditempelkan pada dinding erlenmeyer kemudian bilas dan goyangkan. Ada baiknya titrasi dilakukan sebanyak dua atau tiga kali. Titrasi dihentikan ketika terjadi perubahan warna yang bersifat menetap (walaupun gelas digoyangkan, warna tidak hilang). Pada saat ini telah terjadi titik ekivalen.
5. Catat jumlah volume titran yang telah dipakai. Proses titrasi telah selesai.
6. Selanjutnya, penentuan konsentrasi titrat dapat dihitung dengan menggunakan rumus titrasi.
1. Siapkan larutan yang akan ditentukan molaritasnya.
2. Pilih indikator berdasarkan trayek pH dan perubahan warna indikator untuk memudahkan pengamatan. Tambahkan beberapa tetes pada larutan.
3. Tambahkan zat penitrasi setetes demi setetes dengan selalu menggoyangkan erlenmeyer agar terjadi reaksi sempurna.
4. Ketika mendekati titik ekuivalen, penambahan zat penetrasi dilakukan dengan sangat hati-hati. Buka kran buret, peniter yang keluar jangan sampai menetes, tetapi ditempelkan pada dinding erlenmeyer kemudian bilas dan goyangkan. Ada baiknya titrasi dilakukan sebanyak dua atau tiga kali. Titrasi dihentikan ketika terjadi perubahan warna yang bersifat menetap (walaupun gelas digoyangkan, warna tidak hilang). Pada saat ini telah terjadi titik ekivalen.
5. Catat jumlah volume titran yang telah dipakai. Proses titrasi telah selesai.
6. Selanjutnya, penentuan konsentrasi titrat dapat dihitung dengan menggunakan rumus titrasi.
4. Rumus Umum Titrasi
Pada saat titik ekuivalen dicapai, maka mol-ekuivalen asam akan sama dengan mol-ekuivalen basa, maka hal ini dapat kita tulis sebagai berikut:
Mol ekuivalen asam = mol ekuivalen basa
Mol ekuivalen diperoleh dari hasil perkalian antara Normalitas dengan volume, sehingga rumus diatas dapat kita tulis sebagai:
NVasam = NVbasa
Normalitas diperoleh dari hasil perkalian antara molaritas (M) dengan jumlah ion H+ pada asam atau jumlah ion OH- pada basa, sehingga rumus diatas menjadi:
nMVasam = nMVbasa
Keterangan
N = Normalitas
V = Volume
M = Molaritas
n = Jumlah ion H+ pada asam atau ion OH- pada basa
N = Normalitas
V = Volume
M = Molaritas
n = Jumlah ion H+ pada asam atau ion OH- pada basa
Untuk memperjelas cara penentuan konsentrasi, marilah kita perhatikan contoh-contoh soal berikut:
Contoh soal
Pada titrasi 25 mL NaOH dengan HCl 0,2 M memakai indikator fenofthalin, dibutuhkan HCl 0,2 M sebanyak 50 mL. Tentukan konsentrasi NaOH tersebut.
Tahapan Penyelesaian
1. Menentukan jumlah ion hidrogen (H+) pada asam dan ion hidroksida (OH-) pada basa
- Pada asam, jumlah ion (H+) sebanyak 1, sehingga [H+)] = [HCl]
- Pada basa, jumlah ion (OH-) sebanyak 1, sehingga [OH-] = [NaOH]
2. Selanjutnya, kita memakai rumus berikut
nMVasam = nMVbasa
1 x 0,2 x 50 mL = 1 x M x 25 mL
1 x M = M x 25
M = 0,04 M
sehingga [NaOH] = 0,04 M dan nilai ini sama dengan [OH-].
- Pada asam, jumlah ion (H+) sebanyak 1, sehingga [H+)] = [HCl]
- Pada basa, jumlah ion (OH-) sebanyak 1, sehingga [OH-] = [NaOH]
2. Selanjutnya, kita memakai rumus berikut
nMVasam = nMVbasa
1 x 0,2 x 50 mL = 1 x M x 25 mL
1 x M = M x 25
M = 0,04 M
sehingga [NaOH] = 0,04 M dan nilai ini sama dengan [OH-].
S1
Pernyataan yang tepat tentang titrasi adalah ....
S2
Titrasi asidimetri adalah....
S3
Perbedaan antara titran dan titrat yang tepat adalah ....
S4
Jika 10 mL KOH dititrasi dengan 10 mL HBr 0,002 M, maka konsentrasi KOH pada titik ekivalen adalah ....
S5
Pada titrasi 20 mL H2SO4 dengan LiOH 0,3 M, pada titik ekivalen diperoleh data sebagai berikut.

Berdasarkan tabel di atas, konsentrasi H2SO4 yang tepat adalah ….
S6
Volume Mg(OH)2 0,1 M yang dititrasi dengan 200 mL H3PO4 0,2 M adalah ....
S7
Suatu basa L(OH)x dapat dititrasi dengan 20 mL HI 0,2 M. Jika konsentrasi basa tersebut sebesar 0,1 M dan dipakai sebanyak 10 mL, maka nilai x yang memenuhi adalah ....
S8
Pada titrasi asam kuat dengan basa kuat akan dihasilkan zat yang bersifat ....
S9
Suatu asam HyX sebanyak 20 mL memiliki konsentrasi 0,4 M. Asam tersebut dititrasi dengan 10 mL Mg(OH)2 0,8 M. Rumus HyX yang tepat adalah ....
S10
Pada titrasi, kita mengenal adanya titik ekivalen. Pernyataan yang benar tentang titik ekivalen adalah ....
