Contoh Soal Meramalkan bentuk molekul
Contoh Soal Meramalkan bentuk molekul - Pada topik sebelumnya, kalian telah belajar mengenai molekul polar dan nonpolar. Pada topik kali ini, kalian akan mempelajari bagaimana cara meramalkan bentuk dari molekul-molekul itu.
MERAMALKAN BENTUK MOLEKUL
Bentuk molekul berhubungan dengan susunan atom-atom dalam molekul. Bentuk molekul ini dapat diramalkan berdasarkan teori VSEPR (Valence Shell Electron Pair Repulsion), yaitu teori tolakan pasangan elektron pada kulit terluar. Dikenal juga sebagai teori domain elektron.
Menurut teori VSEPR, pasangan elektron valensi di sekitar atom akan saling tolak menolak sehingga pasangan elektron tersebut akan menempatkan diri pada susunan yang meminimalisasi gaya tolak menolak.
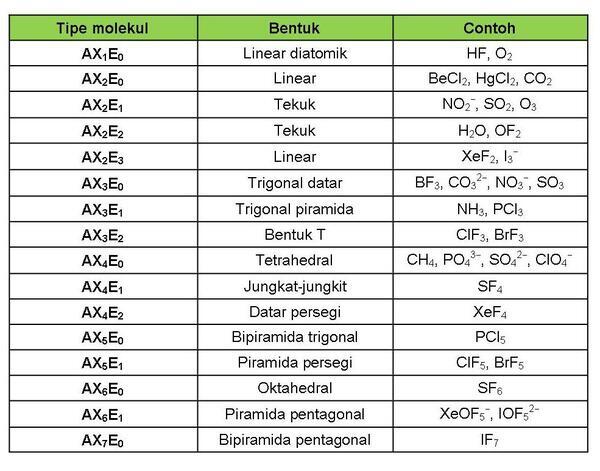
Dalam teori VSEPR, kita dapat meramalkan bentuk molekul dengan metode perhitungan elektron AXE. A mewakili atom pusat. X mewakili jumlah ikatan sigma antara atom pusat dan atom luar. E mewakili jumlah pasangan elektron bebas yang ada di sekitar atom pusat. Jumlah X dan E disebut sebagai bilangan sterik.
Menurut teori VSEPR, pasangan elektron valensi di sekitar atom akan saling tolak menolak sehingga pasangan elektron tersebut akan menempatkan diri pada susunan yang meminimalisasi gaya tolak menolak.
Dalam teori VSEPR, kita dapat meramalkan bentuk molekul dengan metode perhitungan elektron AXE. A mewakili atom pusat. X mewakili jumlah ikatan sigma antara atom pusat dan atom luar. E mewakili jumlah pasangan elektron bebas yang ada di sekitar atom pusat. Jumlah X dan E disebut sebagai bilangan sterik.

Agar kamu lebih paham, mari kita berlatih soal-soal berikut.
S1
Suatu senyawa memiliki jumlah ikatan sigma 3 dan pasangan elektron bebas 0. Bentuk molekul dari senyawa tersebut adalah ….
S2
Senyawa berikut ini memiliki PEB berjumlah 1, kecuali ....
S3
Bentuk molekul senyawa SF6 adalah ....
S4
Molekul yang di sekeliling atom pusatnya terdapat 4 pasangan elektron ikatan akan membentuk molekul berbentuk ....
S5
Suatu senyawa mempunyai bentuk molekul bipiramida trigonal. Jumlah ikatan sigma dalam senyawa tersebut adalah ....
S6
Bentuk geometri molekul senyawa NI3 yang mempunyai 3 pasangan elektron terikat dan 1 pasangan elektron bebas adalah .
S7
Suatu senyawa memiliki 4 ikatan sigma dan 2 pasangan elektron bebas. Senyawa itu kemungkinan adalah ....
S8
Atom 15P dan 35Br dapat berikatan membentuk senyawa PBr5. Bentuk molekulnya adalah …
S9
Penyebab sudut ikatan pada molekul H2O lebih kecil daripada sudut ikatan pada molekul SO2 adalah ….
S10
Molekul senyawa berikut memiliki pasangan elektron ikatan sebanyak 2, kecuali ....
