Contoh Soal Hidrolisis total garam
Contoh Soal Hidrolisis total garam - Pada topik sebelumnya kalian sudah mempelajari mengenai hidrolisis partial garam yang bersifat basa. Pada topik kali ini, kalian akan mempelajari mengenai hidrolisis total garam.
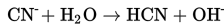
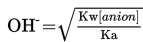
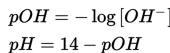
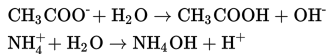
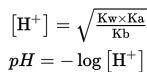
Mari ingat kembali mengenai hidrolisis partial garam yang bersifat basa.
1. Hidrolisis Partial Garam yang Bersifat Basa
Hidrolisis partial garam yang bersifat basa terjadi jika garam tersusun atas kation berupa asam konjugat dari basa kuat dan anion berupa basa konjugat dari asam lemah. Anion berupa basa konjugat dari asam lemahnya akan bereksi dengan air menghasilkan ion OH- seperti reaksi di bawah ini.
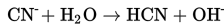
Keberadaan ion OH- menyebabkan sifat garam menjadi basa.
Contoh garam yang bersifat asam diantaranya: CH3COONa, KCN, dan CaF2
Untuk menentukan pH larutan garam yang besifat basa ini dapat dilakukan dengan menggunakan persamaan berikut.
Contoh garam yang bersifat asam diantaranya: CH3COONa, KCN, dan CaF2
Untuk menentukan pH larutan garam yang besifat basa ini dapat dilakukan dengan menggunakan persamaan berikut.
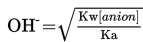
Keterangan
Kw = 10-14
Ka = Tetapan basa lemah
[anion]= konsentrasi anion (basa konjugat)
Setelah diketahui konsentrasi OH-, maka bisa ditentukan nilai pH nya dengan persamaan penentuan pH sebagai berikut.
Kw = 10-14
Ka = Tetapan basa lemah
[anion]= konsentrasi anion (basa konjugat)
Setelah diketahui konsentrasi OH-, maka bisa ditentukan nilai pH nya dengan persamaan penentuan pH sebagai berikut.
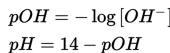
Gimana sudah ingat kembali? Kalau sudah ingat mari kita lanjutkan pada topik selanjutnya.
2. Hidrolisis Total Garam
Garam yang mengalami hidrolisis total merupakan garam yang tersusun dari kation berupa asam konjugat dari basa lemahnya dan anion berupa basa konjugat dari asam lemahnya. Kation dan anion tersebut akan bereaksi dengan air menghasilkan ion H+ dan ion OH-. Salah satu contoh garam yang mengalami hidrolisis total adalah CH3COONH4.
Reaksi hidrolisis CH3COONH4 yang terjadi sebagai berikut.
Reaksi hidrolisis CH3COONH4 yang terjadi sebagai berikut.
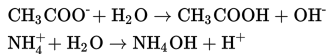
Sifat garam yang mengalami hidrolisis total tergantung dari nilai Ka dari asam lemahnya dan Kb dari basa lemahnya. Adpaun ketentuannya sebagai berikut.
Jika Ka > Kb, maka sifat garamnya asam.
Jika Ka < Kb, maka sifat garamnya basa.
Jika Ka = Kb, maka sifat garamnya netral.
Jika Ka > Kb, maka sifat garamnya asam.
Jika Ka < Kb, maka sifat garamnya basa.
Jika Ka = Kb, maka sifat garamnya netral.
Untuk menentukan pH dari larutan garam yang mengalami hidrolisis total dapat menggunakan persamaan berikut.
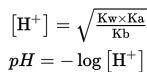
Contoh garam yang mengalami hidrolisis total adalah BeCO3. Garam yang mengalami hidrolisis total tersusun dari kation dan anion yang berasal dari asam lemah dan basa lemah. BeCO3 merupakan garam yang mengalami hidrolisis total karena Be2+ merupakan kation (asam konjugat) dari basa lemah Be(OH)2 dan CO32- merupakan anion (basa konjugat) dari asam lemah H2CO3.
Contoh Soal
10 mL CH3COOH 0,1 M (Ka = 1,75 x 10-5) dicampurkan dengan 10 mL NH3 0,1 M (Kb = 1,8 x 10-5). Pernyataan mengenai sifat garam yang terbentuk adalah ....
10 mL CH3COOH 0,1 M (Ka = 1,75 x 10-5) dicampurkan dengan 10 mL NH3 0,1 M (Kb = 1,8 x 10-5). Pernyataan mengenai sifat garam yang terbentuk adalah ....
Penyelesaian
Untuk menentukan sifat garam dari pencampuran asam lemah dan basa lemah dapat dilihat dari nilai Ka dan Kb, berdasarkan soal terlihat bahwa nilai Kb > Ka, maka sifat garam yang terbentuk adalah basa.
Untuk menentukan sifat garam dari pencampuran asam lemah dan basa lemah dapat dilihat dari nilai Ka dan Kb, berdasarkan soal terlihat bahwa nilai Kb > Ka, maka sifat garam yang terbentuk adalah basa.
S1
Garam berikut ini yang mengalami hidrolisis total adalah ....
S2
Dalam suatu gelas kimia terdapat 250 mL larutan garam LiCN. Diketahui Ka HCN sama dengan Kb LiOH. Hal yang akan terjadi pada kertas lakmus merah dan biru jika keduanya dicelupkan ke dalam larutan garam tersebut adalah ....
S3
Garam Al2S3 mengalami hidrolisis total, pernyataan yang tepat mengenai garam tersebut adalah ....
S4
Campuran berikut ini yang dapat mengalami hidrolisis total adalah ....
S5
Jika Ka CH3COOH = 1,75 x 10-5, Kb NH3 = 1,8 x 10-5, maka pH larutan garam CH3COONH4 0,1 M adalah ....
S6
100 mL CH3COOH 0,1 M direaksikan dengan 100 mL NH4OH 0,1 M menghasilkan garam dan air. Jika Ka CH3COOH = 2 x 10-5 dan Kb NH4OH = 2 x 10-5, maka pH garam yang dihasilkan dari reaksi tersebut adalah ....
S7
20 mL NH3 0,15 M (Kb NH3 = 1,8 x 10-5) akan membentuk garam yang terhidrolisis total bersifat basa jika dicampurkan dengan larutan ....
S8
Reaksi hidrolisis total pada garam NH4F adalah ….
S9
25 mL HCN 0,1 M (Ka = 4,9 x 10-10) dicampurkan dengan 25 mL NH3 0,1 M (Kb = 1,8 x 10-5). pH campuran larutan tersebut adalah ....
S10
Berikut ini merupakan beberapa senyawa asam dan basa.
1. H2SO4
2. HNO2
3. CHOOH
4. HBr
5. NH3
6. Ca(OH) 2
7. KOH
8. Fe(OH)2
Berdasarkan pada asam dan basa tersebut, pasangan asam dan basa yang dapat menghasilkan garam yang mengalami hidrolisis total ditunjukkan oleh nomor ....
1. H2SO4
2. HNO2
3. CHOOH
4. HBr
5. NH3
6. Ca(OH) 2
7. KOH
8. Fe(OH)2
Berdasarkan pada asam dan basa tersebut, pasangan asam dan basa yang dapat menghasilkan garam yang mengalami hidrolisis total ditunjukkan oleh nomor ....
