Contoh Soal Hidrolisis garam
Contoh Soal Hidrolisis garam - Pada topik sebelumnya kalian sudah mempelajari mengenai Reaksi Asam Basa. Pada topik kali ini, kalian akan mempelajari mengenai hidrolisis garam. Apakah itu hidrolisis garam? Bagaimana mekanisme hidrolisis tersebut? Mari kita pelajari di dalam topik ini.
Sebelumnya mari kita ulas kembali mengenai senyawa asam dan basa, beserta reaksinya.
1. Pengertian Asam dan Basa Menurut Beberapa Ahli
a. Arrhenius
Asam adalah senyawa yang melepaskan ion H+ ketika dilarutkan dalam air, sedangkan basa adalah adalah senyawa yang melepaskan ion OH- ketika dilarutkan dalam air.
b. Bronsted Lowry
Asam adalah spesi/senyawa yang melepaskan/donor proton kepada senyawa lain, sedangkan basa adalah spesi/senyawa yang menerima/akseptor proton dari senyawa lain.
c. Lewis
Asam adalah spesi/senyawa yang menerima / akseptor pasangan elektron dari senyawa lain, sedangkan basa adalah spesi/senyawa yang memberikan / donor pasangan elektron kepada senyawa lain.
Asam adalah senyawa yang melepaskan ion H+ ketika dilarutkan dalam air, sedangkan basa adalah adalah senyawa yang melepaskan ion OH- ketika dilarutkan dalam air.
b. Bronsted Lowry
Asam adalah spesi/senyawa yang melepaskan/donor proton kepada senyawa lain, sedangkan basa adalah spesi/senyawa yang menerima/akseptor proton dari senyawa lain.
c. Lewis
Asam adalah spesi/senyawa yang menerima / akseptor pasangan elektron dari senyawa lain, sedangkan basa adalah spesi/senyawa yang memberikan / donor pasangan elektron kepada senyawa lain.
2. Reaksi Asam dan Basa
Reaksi antara asam dan basa akan menghasilkan garam dan air. Reaksi tersebut dikenal dengan reaksi penetralan. Contoh dari reaksi penetralan adalah sebagai berikut.
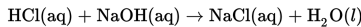
Asam klorida (HCl) bereaksi dengan natrium hidroksida (NaOH) membentuk suatu garam (NaCl). Pada reaksi tersebut garam yang dihasilkan (NaCl) bersifat netral (memiliki pH = 7).
Jika asam bromida (HBr) direaksikan dengan kalium hidroksida (KOH), maka akan terbentuk garam KBr. Garam KBr jika diuraikan terdiri dari K+ dan Br-.
Gimana sudah ingat kembali? Kalau sudah ingat kembali, mari kita lanjutkan ke topik hidrolisis garam.
Gimana sudah ingat kembali? Kalau sudah ingat kembali, mari kita lanjutkan ke topik hidrolisis garam.
3. Hidrolisis Garam
Seperti pada pembahasan sebelumnya diketahui bahwa hasil reaksi antara asam dan basa adalah garam. Kemudian, apakah penyusun garam-garam tersebut? Garam yang terbentuk tersusun dari kation (ion bermuatan positif) dan anion (ion bermuatan negatif). Kation-kation garam yang berasal dari basa lemah disebut asam konjugat, kation-kation tersebut antara lain: NH4+, Al3+ dan Li+. Anion-anion garam yang berasal dari asam lemah disebut basa konjugat, anion-anion tersebut antara lain: F-, CN- , CH3COO-.
Asam dan basa konjugat tersebut dapat bereaksi dengan air sehingga memicu terjadinya pelepasan ion H+ atau H3+ dan ion OH-. Reaksi tersebut dinamakan hidrolisis garam. Asam konjugat akan menghasilkan ion H+ saat bereaksi dengan air, sedangkan basa konjugat akan membentuk ion OH- saat bereaksi dengan air. NaF merupakan contoh garam yang dapat mengalami hidrolisis saat bereaksi dengan air. NaF merupakan garam yang tersusun atas kation Na+ dan F-. Ion F- merupakan anion yang berasal dari asam lemah sehingga ketika bereaksi dengan air akan menghasilkan ion OH-.
Asam dan basa konjugat tersebut dapat bereaksi dengan air sehingga memicu terjadinya pelepasan ion H+ atau H3+ dan ion OH-. Reaksi tersebut dinamakan hidrolisis garam. Asam konjugat akan menghasilkan ion H+ saat bereaksi dengan air, sedangkan basa konjugat akan membentuk ion OH- saat bereaksi dengan air. NaF merupakan contoh garam yang dapat mengalami hidrolisis saat bereaksi dengan air. NaF merupakan garam yang tersusun atas kation Na+ dan F-. Ion F- merupakan anion yang berasal dari asam lemah sehingga ketika bereaksi dengan air akan menghasilkan ion OH-.
Contoh Soal
Garam berikut yang penyusunnya dapat menghasilkan ion OH-adalah KCN
Penyelesaian
Garam penyusunnya dapat menghasilkan ion OH- adalah garam yang memiliki anion yang berasal dari asam lemah. Pada KCN terdapat ion CN- yang berasal dari asam lemah HCN.
Garam berikut yang penyusunnya dapat menghasilkan ion OH-adalah KCN
Penyelesaian
Garam penyusunnya dapat menghasilkan ion OH- adalah garam yang memiliki anion yang berasal dari asam lemah. Pada KCN terdapat ion CN- yang berasal dari asam lemah HCN.
S1
Garam berikut yang tidak dapat mengalami hidrolisis adalah ....
S2
Garam berikut yang penyusunnya dapat bereaksi dengan air dan menghasilkan ion H+ adalah ....
S3
Garam berikut yang penyusunnya dapat bereaksi dengan air dan menghasilkan ion OH- adalah ....
S4
Berikut ini pasangan asam basa yang menghasilkan garam yang dapat mengalami hidrolisis adalah ....
S5
Pernyataan yang tepat mengenai garam (NH4)2SO4 adalah ....
S6
Pernyataan yang tepat mengenai garam KCl adalah ....
S7
Suatu gelas kimia berisi larutan garam X. Pada larutan tersebut dicelupkan kertas lakmus merah dan berubah jadi warna biru. Berdasarkan data tersebut, perkirakanlah garam X tersebut adalah ....
S8
Berikut ini reaksi hidrolisis yang tepat adalah ....
S9
Garam NH4CN merupakan garam yang dapat mengalami hidrolisis, reaksi hidrolisis untuk garam NH4CN adalah ….
S10
Suatu garam X tersusun atas kation berupa asam konjugat yang berasal dari basa kuat dan anion berupa basa konjugat dari asam lemah. Berdasarkan data tersebut, pernyataan yang benar mengenai garam X tersebut adalah ....
