Contoh Soal Hidrolisis partial garam yang bersifat asam
Contoh Soal Hidrolisis partial garam yang bersifat asam - Pada topik sebelumnya kalian sudah mempelajari mengenai hidrolisis garam. Pada topik kali ini, kalian akan mempelajari mengenai hidrolisis partial garam yang bersifat asam.
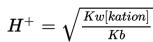
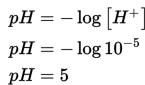
Mari ingat kembali mengenai hidrolisis garam.
1. Hidrolisis Garam
Hidrolisis garam adalah reaksi antara kation yang berasal dari basa lemah dengan air menghasilkan ion H+ dan reaksi antara anion yang berasal dari asam lemah dengan air menghasilkan ion OH-. Berdasarkan jenis anion/kation yang dapat bereaksi dengan air, hidrolisis dibagi menjadi tiga, yaitu :
a. hidrolisis partial garam yang bersifat asam;
b. hidrolisis partial garam yang bersifat basa; dan
c. hidrolisis total.
Bagaimana sudah ingat kembali? Kalau sudah ingat kembali, mari kita lanjutkan ke topik hidrolisis partial garam yang bersifat asam.
a. hidrolisis partial garam yang bersifat asam;
b. hidrolisis partial garam yang bersifat basa; dan
c. hidrolisis total.
Bagaimana sudah ingat kembali? Kalau sudah ingat kembali, mari kita lanjutkan ke topik hidrolisis partial garam yang bersifat asam.
2. Hidrolisis Partial Garam yang Bersifat Asam
Hidrolisis partial garam yang bersifat asam terjadi jika garam tersusun atas kation berupa asam konjugat dari basa lemah dan anion berupa basa konjugat dari asam kuat. Asam konjugat tersebut akan bereksi dengan air menghasilkan ion H+seperti terlihat pada reaksi di bawah ini.
NH4+ + H2O → NH4OH + H+
keberadaan ion H+ menyebabkan sifat garam menjadi asam.
Contoh garam yang bersifat asam NH4+ dan AlBr3.
Untuk menentukan pH larutan dari garam yang besifat asam ini dapat dihitung dengan persamaan berikut.
Contoh garam yang bersifat asam NH4+ dan AlBr3.
Untuk menentukan pH larutan dari garam yang besifat asam ini dapat dihitung dengan persamaan berikut.
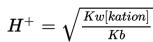
Keterangan
Kw = 10-14
Kb = Tetapan basa lemah
[kation]= konsentrasi kation (asam konjugat)
Kw = 10-14
Kb = Tetapan basa lemah
[kation]= konsentrasi kation (asam konjugat)
Setelah diketahui konsentrasi H+, maka bisa ditentukan nilai pH nya dengan persamaan penentuan pH sebagai berikut.
pH = - log [H+]
Contoh garam yang dapat memerahkan lakmus biru (bersifat asam) adalah NH4Cl. Garam tersebut dapat memerahkan lakmus biru karena mengandung ion NH4+ dan Cl-. Ion NH4+ merupakan asam konjugat yang berasal dari basa lemah, sedangkan ion Cl- berasal dari asam kuat HCl. Ion yang dapat mengalami hidrolisis adalah ion yang berasal dari asam/ basa lemah, dalam hal ini adalah ion NH4+. Ion tersebut dan dapat bereaksi dengan air menghasilkan ion H+(bersifat asam).
Contoh Soal
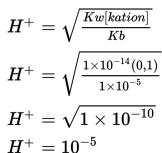
Tentukan pH garam NH4Br 0,1 M jika NH4OH memiliki Kb = 10-5!
Penyelesaian
Langkah-langkah penyelesaian
Menentukan komponen yang diketahui: Kw = 10-14, Kb = 10-5! Tentukan konsentrasi H+ dengan cara memasukan yang diketahui pada persamaan berikut.
Tentukan pH garam NH4Br 0,1 M jika NH4OH memiliki Kb = 10-5!
Penyelesaian
Langkah-langkah penyelesaian
Menentukan komponen yang diketahui: Kw = 10-14, Kb = 10-5! Tentukan konsentrasi H+ dengan cara memasukan yang diketahui pada persamaan berikut.

Menentukan pH dengan cara mensubstitusi konsentrasi H+ pada persamaan berikut.
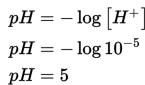
S1
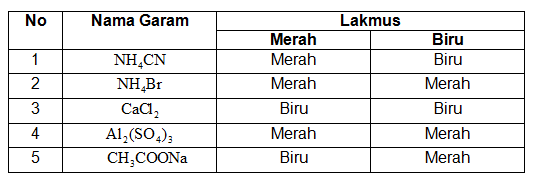
Data suatu percobaan ditampilkan pada tabel berikut ini.

Berdasarkan data pada tabel di atas, garam yang bersifat asam adalah ....
S2
Garam berikut ini yang memiliki pH < 7 adalah .
S3
Larutan NH4Cl dalam air akan bersifat asam. Reaksi yang menunjukkan terjadinya sifat asam tersebut adalah ....
S4
pH larutan garam ZnCl2 0,1 M adalah .... (Kb Zn(OH) 2= 2,5 x 10-4)
S5
Jika Kb NH3 = 2 x 10-5 dan log 3 = 0,47, maka pH larutan garam (NH4)2SO4 0,009 M adalah ....
S6
Reaksi asam basa berikut yang menghasilkan garam yang bersifat asam adalah ....
S7
Perhatikan data senyawa asam basa berikut.
1. 200 mL HNO3 0,1 M
2. 100 mL CH3COOH 0,1 M
3. 200 mL HBr 0,2 M
4. 100 mL NaOH 0,1 M
5. 100 mL NH3 0,2 M
6. 100 mL LiOH 0,1 M
1. 200 mL HNO3 0,1 M
2. 100 mL CH3COOH 0,1 M
3. 200 mL HBr 0,2 M
4. 100 mL NaOH 0,1 M
5. 100 mL NH3 0,2 M
6. 100 mL LiOH 0,1 M
Pasangan asam basa yang dapat membentuk garam bersifat asam adalah ....
S8
100 mL H2SO4 0,2 M dicampurkan dengan 200 mL NH3 0,2 M. Hasil pencampuran tersebut menghasilkan garam (NH4)2SO4. Berdasarkan reaksi tersebut pernyataan yang tepat mengenai garam yang dihasilkan adalah ....
S9
100 mL HCl 0,2 M dicampurkan dengan 100 mL NH3 0,2 M. pH campuran larutan tersebut adalah .... (Kb = 10-5)
S10
Larutan NH4 Cl memiliki pH = 5. Massa NH4 Cl yang harus dilarutkan ke dalam 100 mL larutan untuk membuat larutan NH4Cl dengan pH = 5 tersebut adalah .... (Kb= 10-5, Mr NH4 Cl= 53,5)
