Contoh Soal Gaya antar molekul
Contoh Soal Gaya antar molekul - Pada topik sebelumnya, kalian telah mempelajari ikatan dalam suatu molekul, baik ikatan ion, kovalen, maupun ikatan kovalen koordinasi. Ikatan-ikatan tersebut merupakan bentuk interaksi antara satu atom dengan atom lain dalam membentuk suatu senyawa/molekul.
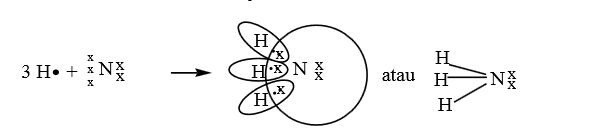
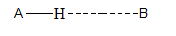
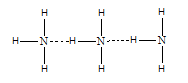
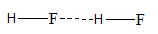
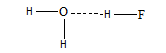
Untuk mengingatnya kembali, mari perhatikan contoh berikut.
Ikatan Kimia
a. Ikatan Ion
Ikatan ion merupakan ikatan antaratom logam dengan atom nonlogam. Ikatan ini terjadi melalui serah terima elektron.
Misalnya ikatan atom Na dengan atom Cl membentuk NaCl.
b. Ikatan Kovalen
Ikatan kovalen merupakan ikatan yang terjadi antaratom nonlogam. Ikatan ini terjadi melalui pemakaian bersama pasangan elektron yang disumbangkan bersama. Misalnya: ikatan antar 3 atom H dengan 1 atom N membentuk NH3.
Ikatan ion merupakan ikatan antaratom logam dengan atom nonlogam. Ikatan ini terjadi melalui serah terima elektron.
Misalnya ikatan atom Na dengan atom Cl membentuk NaCl.
b. Ikatan Kovalen
Ikatan kovalen merupakan ikatan yang terjadi antaratom nonlogam. Ikatan ini terjadi melalui pemakaian bersama pasangan elektron yang disumbangkan bersama. Misalnya: ikatan antar 3 atom H dengan 1 atom N membentuk NH3.
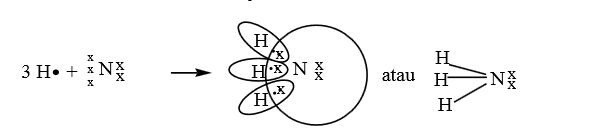
c. Ikatan Kovalen Koordinatif (dativ)
Ikatan kovalen koordinasi merupakan ikatan kovalen dimana pasangan elektron yang dipakai bersama berasal dari salah satu atom.
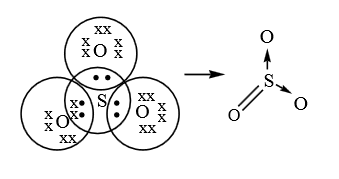
Misalnya: ikatan antar 3 atom O dengan 1 atom S membentuk SO3.
Ikatan kovalen koordinasi merupakan ikatan kovalen dimana pasangan elektron yang dipakai bersama berasal dari salah satu atom.
Misalnya: ikatan antar 3 atom O dengan 1 atom S membentuk SO3.

Pada contoh di atas, interaksi yang terjadi adalah antarsatu atom dengan atom lain membentuk satu senyawa/molekul.
Pada topik ini, kalian akan mempelajari interaksi antara satu molekul dengan molekul/senyawa lain baik molekul sejenis maupun yang berlainan jenis serta pengaruh interaksi tersebut terhadap sifat senyawa.
Pada topik ini, kalian akan mempelajari interaksi antara satu molekul dengan molekul/senyawa lain baik molekul sejenis maupun yang berlainan jenis serta pengaruh interaksi tersebut terhadap sifat senyawa.
Gaya Antarmolekul
Gaya antarmolekul merupakan interaksi antarsatu molekuI dengan molekul lain, baik sejenis maupun berbeda jenis. Gaya antarmolekul disebut juga sebagai Gaya van der Waals.
Jenis-Jenis gaya antarmolekul
Jenis-Jenis gaya antarmolekul
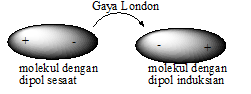
A.Gaya dipol sesaat-dipol induksian (gaya London)
Gaya London adalah interaksi yang terjadi antarmolekul nonpolar, baik antarmolekul nonpolar sejenis maupun antarmolekul nonpolar berlainan jenis. Gaya London merupakan gaya yang paling lemah. Meskipun demikian, adanya gaya London menyebabkan senyawa-senyawa nonpolar dapat dicairkan atau dipadatkan.
Gaya London adalah interaksi yang terjadi antarmolekul nonpolar, baik antarmolekul nonpolar sejenis maupun antarmolekul nonpolar berlainan jenis. Gaya London merupakan gaya yang paling lemah. Meskipun demikian, adanya gaya London menyebabkan senyawa-senyawa nonpolar dapat dicairkan atau dipadatkan.
Proses terjadinya gaya London dapat dijelaskan sebagai berikut.
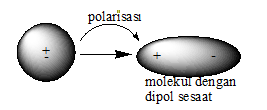
1.Perputaran elektron pada suatu molekul menyebabkan polarisasi rapatan elektron dalam waktu yang singkat. Hal ini menyebabkan pusat muatan positif dan negatif memisah sehingga molekul dikatakan memiliki dipol sesaat.
1.Perputaran elektron pada suatu molekul menyebabkan polarisasi rapatan elektron dalam waktu yang singkat. Hal ini menyebabkan pusat muatan positif dan negatif memisah sehingga molekul dikatakan memiliki dipol sesaat.

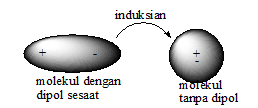
2.Dalam waktu yang singkat pula, dipol sesaat ini akan hilang dan timbul kembali. Hal ini terjadi secara terus menerus. Apabila di dekatnya terdapat molekul nonpolar sejenis atau berlainan jenis, maka molekul dipol sesaat akan menginduksi (mengimbas) molekul tersebut sehingga terjadi dipol induksian.

3.Setelah kedua molekul tersebut membentuk dipol sesaat dan dipol induksian, di antara keduanya akan terjadi gaya tarik elektrostatik yang disebut gaya London.

Gaya london dapat terjadi antara:
- molekul CCl4 dalam cairan CCl4 (sejenis); dan
- molekul CCl4 dengan molekul CS2 (berbeda jenis).
- molekul CCl4 dalam cairan CCl4 (sejenis); dan
- molekul CCl4 dengan molekul CS2 (berbeda jenis).
Molekul-molekul dengan interaksi gaya London, mempunyai sifat fisik (titik didih dan titik lebur) yang berbeda. Semakin banyak elektron yang dimiliki, maka semakin mudah membentuk polarisasi. Akibatnya gaya London yang terjadi semakin kuat. Hal ini menyebabkan titik didih dan titik lebur senyawa semakin tinggi.
Misalnya, titik didih larutan CCl4 lebih tinggi dibandingkan titik didih larutan CH4. Hal ini terjadi karena jumlah elektron CCl4 = 74 lebih banyak dibandingkan jumlah elektron CH4 = 10.
Misalnya, titik didih larutan CCl4 lebih tinggi dibandingkan titik didih larutan CH4. Hal ini terjadi karena jumlah elektron CCl4 = 74 lebih banyak dibandingkan jumlah elektron CH4 = 10.
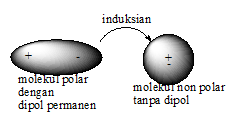
B.Gaya dipol-dipol induksian (gaya London)
Gaya dipol-dipol induksian adalah interaksi yang terjadi antarmolekul polar dengan nonpolar.
Proses terjadinya gaya london dapat dijelaskan sebagai berikut:
1.Molekul polar (yang memiliki dipol permanen) akan menginduksi molekul nonpolar disekitarnya, sehingga terjadi molekul nonpolar dengan dipol induksian.
Gaya dipol-dipol induksian adalah interaksi yang terjadi antarmolekul polar dengan nonpolar.
Proses terjadinya gaya london dapat dijelaskan sebagai berikut:
1.Molekul polar (yang memiliki dipol permanen) akan menginduksi molekul nonpolar disekitarnya, sehingga terjadi molekul nonpolar dengan dipol induksian.

2.Setelah terjadi proses induksian, maka antar kedua molekul tersebut terjadi gaya tarik elektrostatik yang disebut gaya dipol-dipol induksian.

Gaya dipol-dipol induksian dapat terjadi pada molekul:
- Alkohol (polar) dengan I2 (nonpolar); dan
- HCl (polar) dengan CCl4 (nonpolar).
Sifat Senyawa
Dibandingkan dengan senyawa yang mempunyai gaya london, senyawa dengan gaya dipol-dipol induksian relatif memiliki titik didih dan titik lebur yang lebih tinggi. Hal ini disebabkan kekuatan gaya dipol-dipol induksian lebih kuat dibandingkan gaya london, sehingga energi yang dibutuhkan untuk peleburan atau pendidihan akan lebih tinggi.
- Alkohol (polar) dengan I2 (nonpolar); dan
- HCl (polar) dengan CCl4 (nonpolar).
Sifat Senyawa
Dibandingkan dengan senyawa yang mempunyai gaya london, senyawa dengan gaya dipol-dipol induksian relatif memiliki titik didih dan titik lebur yang lebih tinggi. Hal ini disebabkan kekuatan gaya dipol-dipol induksian lebih kuat dibandingkan gaya london, sehingga energi yang dibutuhkan untuk peleburan atau pendidihan akan lebih tinggi.
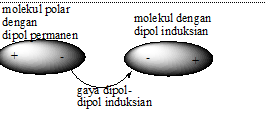
C.Gaya Dipol-Dipol
Gaya dipol-dipol adalah interaksi antar molekul polar yang memiliki dipol permanen. Gaya ini dapat terjadi antar senyawa ionik , antar senyawa kovalen polar maupun antar keduanya.
Sifat fisik (titik didih dan titik lebur) senyawa dipol-dipol cenderung lebih tinggi dibandingkan senyawa dipol-dipol induksian atau senyawa dengan gaya london. Hal ini disebabkan gaya tarik elektrostatik pada senyawa dipol-dipol lebih kuat sebagai akibat adanya dipol permanen dalam kedua molekulnya.
Gaya dipol-dipol dapat terjadi antara:
- Molekul HCl dengan HBr (antar kovalen polar);
- NaCl dengan KCl ( antar ionik); dan
- NaCl dengan HBr (ionik dengan kovalen polar).
Gaya dipol-dipol adalah interaksi antar molekul polar yang memiliki dipol permanen. Gaya ini dapat terjadi antar senyawa ionik , antar senyawa kovalen polar maupun antar keduanya.
Sifat fisik (titik didih dan titik lebur) senyawa dipol-dipol cenderung lebih tinggi dibandingkan senyawa dipol-dipol induksian atau senyawa dengan gaya london. Hal ini disebabkan gaya tarik elektrostatik pada senyawa dipol-dipol lebih kuat sebagai akibat adanya dipol permanen dalam kedua molekulnya.
Gaya dipol-dipol dapat terjadi antara:
- Molekul HCl dengan HBr (antar kovalen polar);
- NaCl dengan KCl ( antar ionik); dan
- NaCl dengan HBr (ionik dengan kovalen polar).
D.Ikatan Hidrogen
Ikatan hidrogen merupakan gaya dipol-dipol yang paling kuat. Ikatan ini dapat terjadi apabila atom H terikat oleh dua atom atau lebih yang memiliki keelektronegatifan tinggi, seperti atom N, O dan F. Ikatan hidrogen dapat digambarkan sebagai berikut.
Ikatan hidrogen merupakan gaya dipol-dipol yang paling kuat. Ikatan ini dapat terjadi apabila atom H terikat oleh dua atom atau lebih yang memiliki keelektronegatifan tinggi, seperti atom N, O dan F. Ikatan hidrogen dapat digambarkan sebagai berikut.
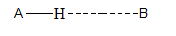
Ikatan H-B merupakan ikatan hidrogen jika jarak H-B lebih panjang dari jarak H-A. A dan B merupakan atom dengan keelektronegatifan tinggi. Contoh ikatan hidrogen.
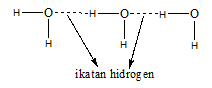
1. Antarmolekul H2O

2. Antarmolekul NH3
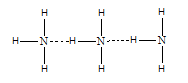
3. Antarmolekul HF
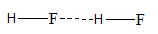
4. Antarmolekul HF dengan H2O
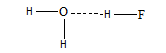
Pengaruh Ikatan Hidrogen terhadap Titik Didih
-Adanya ikatan hidrogen pada suatu zat menyebabkan titik didih dan titik leburnya semakin tinggi. Hal ini terjadi karena kekuatan ikatan hidrogen lebih tinggi dibandingkan kekuatan gaya lain.
Misalnya, titik didih HF lebih tinggi dibandingkan titik didih HCl.
-Semakin banyak ikatan hidrogen yang bisa terbentuk, maka titik didih senyawa makin tinggi
Misalnya, titik didih H2O lebih tinggi dibandingkan HF. Hal ini terjadi karena pada molekul H2O terdapat 4 ikatan hidrogen dengan molekul H2O disekitarnya, sedangkan pada molekul HF hanya terdapat 2 ikatan hidrogen dengan molekul HF disekitarnya.
-Semakin tinggi Mr suatu senyawa, maka titik didihnya makin tinggi.
-Adanya ikatan hidrogen pada suatu zat menyebabkan titik didih dan titik leburnya semakin tinggi. Hal ini terjadi karena kekuatan ikatan hidrogen lebih tinggi dibandingkan kekuatan gaya lain.
Misalnya, titik didih HF lebih tinggi dibandingkan titik didih HCl.
-Semakin banyak ikatan hidrogen yang bisa terbentuk, maka titik didih senyawa makin tinggi
Misalnya, titik didih H2O lebih tinggi dibandingkan HF. Hal ini terjadi karena pada molekul H2O terdapat 4 ikatan hidrogen dengan molekul H2O disekitarnya, sedangkan pada molekul HF hanya terdapat 2 ikatan hidrogen dengan molekul HF disekitarnya.
-Semakin tinggi Mr suatu senyawa, maka titik didihnya makin tinggi.
S1
Gaya antarmolekul yang dapat terjadi pada molekul HCl dengan molekul H2 adalah ….
S2
Pernyataan yang benar tentang ikatan hidrogen adalah….
S3
Titik didih HF lebih tinggi dibandingkan titik didih HCl. Hal ini terjadi karena….
S4
Gaya yang terjadi dalam larutan CCl4 adalah….
S5
Titik lebur air lebih tinggi dibandingkan titik lebur amonia (NH3) karena….
S6
Jenis gaya antarsenyawa ion dengan nonpolar disebut….
S7
Persamaan antara unsur N2 dan Br2 adalah....
S8
Faktor penyebab adanya interaksi dipol-dipol induksian adalah….
S9
Kerapatan molekul HBr lebih rapat dibandingkan dengan HCl. Faktor penyebabnya adalah....
S10
Urutan kekuatan gaya antarmolekul yang benar terdapat pada….
