Contoh Soal Mengenal Sel Elektrolisis
Contoh Soal Mengenal Sel Elektrolisis - Dalam kehidupan sehari-hari, kalian tentu pernah melihat baterai atau aki. Misalnya, baterai pada remote televisi atau aki pada sepeda motor.


Baterai dan aki merupakan contoh aplikasi sel volta dalam kehidupan sehari-hari. Kedua benda tersebut dapat menghasilkan tegangan listrik dari reaksi kimia yang terjadi di dalamnya. Apabila pada sel volta zat kimia diubah menjadi listrik melalui rekasi redoks, maka sel elektrolisis adalah kebalikannya. Lalu, apa sih yang dimaksud dengan sel elektrolisis? Apa hubungannya dengan sel volta? Mari kita pelajari bersama.
☀ KONSEP ▩
Sel volta merupakan sel yang berisi zat kimia untuk menghasilkan listrik melalui reaksi redoks spontan. Sel elektrolisis merupakan kebalikan dari sel volta. Dalam sel elektrolisis, listrik digunakan untuk menghasilkan energi kimia melalui reaksi redoks tidak spontan. Misalnya, pada reaksi pemakaian aki, aki bertindak sebagai sel volta. Sebaliknya, pada reaksi pengisian aki, aki bertindak sebagai sel elektrolisis.
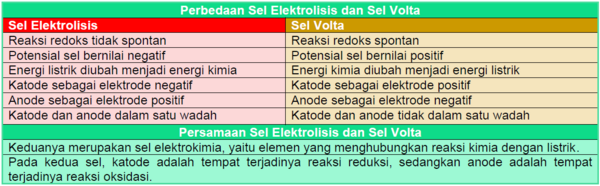
A. Perbedaan Sel Elektrolisis dan Sel Volta
Sel elektrolisis dan sel volta memiliki beberapa perbedaan dan persamaan sebagai berikut.

B. Susunan dan Cara Kerja Sel Elektrolisis
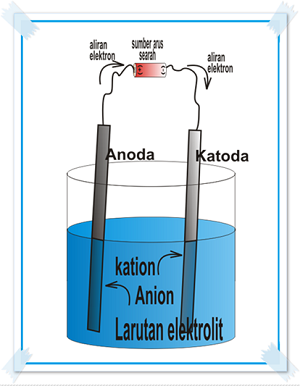
Sel elektrolisis terdiri dari sebuah wadah, elektrode (anode dan katode), larutan elektrolit, dan sumber arus searah. Susunan sel elektrolisis dapat digambarkan sebagai berikut.

Sebelum anode dan katode dihubungkan dengan sumber arus searah, reaksi yang terjadi adalah reaksi redoks tidak spontan, sehingga di dalam larutan tidak terjadi reaksi apa-apa. Setelah anode dan katode dihubungkan dengan sumber arus searah, proses kerja sel elektrolisis dimulai. Dalam hal ini, anode dihubungkan dengan kutub positif sumber arus, sehingga anode bertindak sebegai elektrode positif, sedangkan katode dihubungkan dengan kutub negatif sumber arus, sehingga katode bertindak sebagai elektrode negatif.
Elektron dalam bentuk listrik dari sumber arus mengalir menuju katode. Ion positif atau kation pada elektrolit mengikat elektron dari katode dan mengalami reaksi reduksi. Sementara itu, spesi tertentu dari elektrolit atau elektrode mengalami oksidasi dan melepas elektron di anode. Adanya aliran elektron inilah yang menyebabkan reaksi redoks tidak spontan dapat melangsungkan reaksi pada sel elektrolisis.
Contoh soal
Perbedaan utama antara sel elektrolisis dengan sel volta adalah .…
Penyelesaian:
Pada sel elektrolisis, listrik digunakan untuk menghasilkan energi kimia melalui reaksi redoks tidak spontan, sedangkan pada sel volta, energi kimia digunakan untuk menghasilkan listrik melalui reaksi redoks spontan.
Jadi perbedaan utama keduanya adalah pada sel elektrolisis, listrik digunakan untuk menghasilkan energi kimia, sedangkan pada sel volta, energi kimia digunakan untuk menghasilkan listrik.
S1
Salah satu persamaan antara sel volta dan sel elektrolisis adalah .…
S2
Jika pada sel elektrolisis digunakan arus bolak balik, maka sel tersebut tidak akan bekerja karena .…
S3
Empat komponen utama dalam sel elektrolisis adalah .…
S4
Sumber arus searah pada sel elektrolisis berguna untuk .…
S5
Pernyataan berikut ini yang tepat tentang sel elektrolisis adalah .…
S6
Urutan logam-logam pada deret volta adalah sebagai berikut.
Q – U – I – P – E – R
Jika logam I dijadikan katode, maka anode yang tepat agar sel elektrolisis terjadi adalah .…
S7
Diketahui potensial elektrode beberapa logam sebagai berikut.
Al³⁺ + 3e ⇌ Al E0 = -1,66 V
Mg²⁺ + 2e ⇌ Mg E0 = -2,37 V
Mn²⁺ + 2e ⇌ Mn E0 = -1,18 V
Cr³⁺ + 3e ⇌ Cr E0 = -0,74 V
Sel elektrolisis diperlukan untuk melangsungkan reaksi .…
S8
Diketahui urutan nilai potensial elektrode zat A, B, C, D, dan E adalah sebagai berikut.
Potensial elektrode A > B > C > D > E.
Agar diperoleh sel elektrolisis dengan anoda apapun, maka logam yang menjadi katodenya adalah .…
S9
Suatu percobaan elektrolisis dilakukan dengan memasukkan 2 batang logam X (sebagai elektrode) dalam larutan yang mengandung ion Y²⁺. Ternyata, sebelum disambungkan dengan baterai, larutan langsung berubah warna. Beberapa kesimpulan yang dapat diambil antara lain:
1. percobaan tersebut berhasil;
2. potensial elektrode logam X > Y;
3. potensial elektrode logam X < Y;
4. terjadi sel volta; dan
5. seharusnya logam Y dimasukkan dalam larutan yang mengandung ion X²⁺ .
Kesimpulan yang tepat terdapat pada .…
S10
Reaksi berikut ini merupakan reaksi yang terjadi dengan bantuan arus listrik.
{\rm{2X(s) + 2YN}}{{\rm{O}}_{\rm{3}}}{\rm{(aq) }} \to {\rm{ 2XN}}{{\rm{O}}_{\rm{3}}}{\rm{(aq) + }}{{\rm{Y}}_{\rm{2}}}{\rm{(g)}}
{\rm{2XCl(aq) + 2Z(aq) }} \to {\rm{ 2ZCl(aq) + }}{{\rm{X}}_{\rm{2}}}{\rm{(g)}}
Urutan dari kiri ke kanan logam X, Y, dan Z pada deret volta adalah .…
