Contoh Soal Sifat-Sifat Kimia Unsur Periode Ketiga
Contoh Soal Sifat-Sifat Kimia Unsur Periode Ketiga - Pada topik sebelumnya, kalian telah belajar tentang sifat-sifat fisik unsur periode ketiga. Pada topik ini kalian akan belajar tentang sifat-sifat kimia unsur periode ketiga. Unsur-unsur apa sajakah yang ada pada periode ketiga? Bagaimanakah sifat-sifat kimia unsur periode ketiga? Untuk memahami hal tersebut, perhatikan analogi berikut ini.
Pernahkah kalian mendengar dongeng tentang si kancil dan buaya? Pada dongeng tersebut, kancil digambarkan sebagai hewan yang pintar dan cerdik, sedangkan buaya digambarkan sebagai hewan yang kejam karena ingin memangsa si kancil. Namun, buaya tidak cukup mahir untuk mengalahkan kecerdikan kancil. Begitu juga dengan dongeng lainnya. Serigala digambarkan sebagai hewan yang licik dan jahat, sedangkan ular sebagai hewan yang suka berbohong. Dongeng tersebut disertai gambaran sifat-sifat tokoh/ hewan di dalamnya. Nah, tidak hanya hewan yang digambarkan sifat-sifatnya, unsur-unsur periode ketiga juga mempunyai sifat-sifat kimia yang berbeda antara satu dengan lainnya. Bagaimanakah sifat-sifat kimia unsur periode ketiga? Untuk memahami hal tersebut, simak ulasan berikut.
Unsur-unsur periode ketiga terdiri dari natrium, magnesium dan alumunium (logam), silikon (semilogam) dan fosforus, sulfur, klorin dan argon (nonlogam). Unsur-unsur yang terletak pada periode yang sama, memiliki jumlah elektron valensi yang berbeda. Beberapa sifat kimia unsur periode ketiga, yaitu sebagai berikut.
🔗 Sifat logam dan nonlogam
Unsur periode ketiga dari kiri ke kanan adalah Na, Mg, Al, Si, P, S, Cl, Ar. Sifat kelogaman unsur periode ketiga dari kiri ke kanan akan semakin berkurang. Unsur periode ketiga berdasarkan sifat kelogamannya terbagi 3, yaitu sebagai berikut.
🎯 Unsur-unsur logam, yaitu Na, Mg, dan Al.
🎯 Unsur semilogam (metalloid), yaitu silikon (Si).
🎯 Unsur nonlogam, yaitu P, S, Cl, dan Ar.
1. Unsur logam
Logam natrium, magnesium, dan aluminium berwarna putih keperakan, cepat bereaksi dengan air membentuk basa NaOH.
🍻 Logam natrium bereaksi dengan air raksa membentuk natrium amalgam.
🍻 Logam magnesium dapat diperoleh melalui elektrolisis lelehan MgCl2 dengan elektroda karbon. Logam magnesium banyak digunakan pada proses produksi logam, kaca, dan semen.
🍻 Logam aluminium diperoleh melalui elektrolisis leburan aluminium oksida. Logam aluminium dalam bentuk serbuk mudah terbakar dan menghasilkan panas.
2. Unsur semilogam
Unsur semilogam pada periode ketiga adalah silikon. Unsur silikon bersifat semikonduktor. Silikon memiliki struktur kovalen raksasa, selain itu daya hantar listrik silikon yang kecil (semikonduktor) bermanfaat untuk mengontrol masuknya arus listrik dan sangat efisien. Oleh karena itu, silikon banyak digunakan sebagai bahan dasar transistor, kalkulator, komputer, dan peralatan elektronik lainnya.
3. Unsur nonlogam
Unsur yang bersifat nonlogam pada periode ketiga adalah fosforus, belerang, klorin, dan argon. Fosfor merupakan molekul tetra atomic (P4). Fosfor dapat berpendar dan banyak digunakan pada tabung sinar katoda. Belerang atau sulfur memiliki bentuk molekul okta atomik S8. Belerang dalam bentuk aslinya berupa zat kristalin berwarna kuning. Sulfur banyak digunakan pada bahan mesiu, korek api, insektisida, dan fungisida. Klor membentuk molekul diatomik. Gas klorin berwarna kuning kehijauan dan beracun. Klor dalam bentuk cair banyak digunakan sebagai pemutih dan desinfektan. Argon merupakan unsur nonlogam yang termasuk dalam golongan gas mulia, sangat stabil, dan hampir tidak mengalami reaksi.
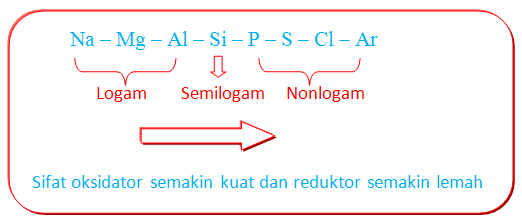
Unsur logam sangat mudah melepaskan elektron, sehingga mudah mengalami oksidasi (reduktor). Unsur nonlogam---kecuali gas mulia---memiliki kecenderungan untuk menangkap elektron, sehingga unsur nonlogam bersifat sebagai oksidator. Jadi, dapat disimpulkan bahwa pada unsur periode ketiga dari kiri ke kanan, sifat reduktor semakin lemah dan sifat oksidatornya semakin kuat.
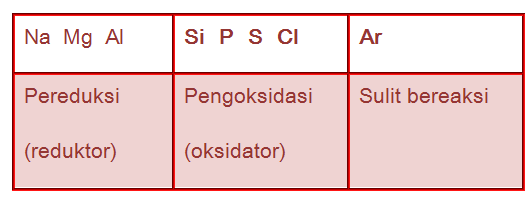

Unsur logam sangat mudah melepaskan elektron, sehingga mudah mengalami oksidasi (reduktor). Unsur nonlogam---kecuali gas mulia---memiliki kecenderungan untuk menangkap elektron, sehingga unsur nonlogam bersifat sebagai oksidator. Jadi, dapat disimpulkan bahwa pada unsur periode ketiga dari kiri ke kanan, sifat reduktor semakin lemah dan sifat oksidatornya semakin kuat.

🔗 Sifat asam dan basa
Asam terbentuk dari unsur nonlogam, sedangkan basa terbentuk dari unsur logam. Hal ini karena unsur logam sulit untuk mengikat elektron (logam cenderung melepaskan elektron), sehingga elektron sulit tertarik ke arah oksigen. Oleh karena itu, kemampuan untuk membentuk ion OH- semakin berkurang. Pada unsur nonlogam, kemampuan mengikat elektron semakin besar (cenderung menangkap elektron), sehingga elektron mudah tertarik ke arah oksigen. Akibatnya, kemampuan membentuk H+ menjadi semakin besar.

1. Sifat basa
Di antara NaOH, Mg(OH)2, dan Al(OH)3, NaOH merupakan basa paling kuat, sedangkan Al(OH)3 basa paling dan bersifat amfoter. Amfoter berarti dapat bersifat basa dan asam sekaligus. Pada lingkungan asam, Al(OH)3 bersifat basa, sedangkan pada lingkungan basa, Al(OH)3 bersifat asam.
Berikut ini merupakan reaksi pada kondisi lingkungan asam.
🍯 Al(OH)3(s) + H+(aq) → Al3+(aq) + 3H2O(l)
Berikut ini merupakan reaksi pada kondisi lingkungan basa.
🍯 Al(OH)3(s) + OH-(aq) → Al(OH)4-
2. Sifat asam
Hidrat silikon (IV) oksida atau SiO2.xH2O bereaksi dengan basa membentuk ion silikat (IV) yang bersifat asam dengan persamaan reaksi berikut.
🍯 SiO2.xH2O + 2OH-(aq) → SiO32-(aq) + H2O(l)
Fosfor memiliki 3 (tiga) bilangan oksidasi, yaitu +1, +3, dan +5, sehingga fosfor dapat membentuk asam hiposfosfit (H3PO2), asam fosfit (H3PO3), dan asam fosfat (H3PO4). Belerang membentuk senyawa asam oksi, yaitu asam sulfit (H2SO3) dan asam sulfat H2SO4. Klor memiliki 4 bilangan oksidasi, yaitu +1, +3, +5, dan +7 yang dapat membentuk asam hipoklorit (HClO), asam klorit (HClO2), asam klorat (HClO3), dan asam perklorat (HClO4).
Pada asam oksi, semakin banyak oksigen yang terikat oleh klor, semakin kuat sifat asamnya. Jika oksigen yang terikat pada klor semakin banyak, maka klor akan menarik elektron dari ikatan OH, sehingga ikatan O dengan H semakin lemah. Akibatnya, kekuatan asam akan bertambah.
Pada asam oksi, semakin banyak oksigen yang terikat oleh klor, semakin kuat sifat asamnya. Jika oksigen yang terikat pada klor semakin banyak, maka klor akan menarik elektron dari ikatan OH, sehingga ikatan O dengan H semakin lemah. Akibatnya, kekuatan asam akan bertambah.
S1
Unsur periode ketiga yang memiliki sifat oksidator paling kuat adalah ....
S2
Hampir semua unsur periode ketiga di alam terikat dalam bentuk senyawa, kecuali unsur belerang karena belerang ....
S3
Berikut ini merupakan unsur-unsur periode ketiga, kecuali ....
S4
Unsur-unsur yang dikelompokkan pada periode ketiga memiliki kesamaan pada ....
S5
Perhatikan urutan kekuatan basa pada unsur periode ketiga berikut ini.
1. Mg(OH)2 > NaOH > Al(OH)3.
2. Al(OH)3 > NaOH > Mg(OH)2.
3. Mg(OH)2 > Al(OH)3 > NaOH.
4. NaOH > Mg(OH)2 > Al(OH)3.
5. Al(OH)3 > Mg(OH)2 > NaOH.
Urutan yang benar ditunjukkan oleh nomor ....
S6
Aluminium hidroksida mampu bersifat basa pada lingkungan asam dan mampu bersifat asam pada lingkungan basa. Oleh karena itu, alumunium hidroksida dikatakan bersifat ....
S7
Pada proses pembakaran logam magnesium akan terbentuk magnesium oksida. Jika magnesium oksida tersebut dilarutkan dalam air, akan dihasilkan senyawa yang dapat membirukan kertas lakmus. Senyawa tersebut adalah ....
S8
Di antara kelima asam oksi berikut ini, senyawa yang memiliki sifat asam yang paling kuat adalah ....
S9
Berikut ini merupakan asam-asam oksi yang dibentuk dari unsur periode ketiga.
1. H3PO4
2. H3PO3
3. H2SiO3
4. H2SO3
5. H2SO4
Asam oksi yang memiliki sifat asam paling lemah adalah ....
S10
Unsur periode ketiga yang memilki sifat reduktor paling kuat dan paling reaktif terhadap air serta udara adalah ....
