Contoh Soal Menentukan hasil oksidasi dan reduksi
Contoh Soal Menentukan hasil oksidasi dan reduksi - Dalam pertemuan ini, kita akan membahas tentang penentuan hasil oksidasi dan reduksi. Sebelumnya kalian pasti telah mempelajari tentang reaksi oksidasi dan reduksi serta penentuan bilangan oksidasi. Mari kita mengingat kembali pelajaran yang telah lalu, agar memudahkan kita dalam mempelajari topik ini.
Jika ditelusuri dari asal katanya, oksidasi berasal dari gas oksigen (O2). Salah satu sifat dari gas oksigen adalah kemampuannya untuk bereaksi dengan berbagai unsur membentuk suatu oksida logam. Jika kita telah mengenal kata oksidasi, tentunya akan familiar juga dengan kata reduksi, dan bagaimana mekanisme untuk membedakan keduanya. Jika ditinjau dari keberadaan biloks, reaksi oksidasi dan reduksi memiliki pengertian sebagai berikut.
Reaksi reduksi adalah reaksi penurunan bilangan oksidasi, sedangkan reaksi oksidasi adalah reaksi kenaikan bilangan oksidasi. Pada beberapa reaksi redoks, zat-zat yang bertindak sebagai reduktor dan oksidator merupakan zat sama sehingga dinamakan reaksi autoredoks. Reduktor merupakan zat yang mengalami oksidasi sedangkan oksidator merupakan zat yang mengalami reduksi. Untuk memahami mana reaksi yang mengalami reduksi dan oksidasi, kita wajib mengetahui konsep penentuan bilangan oksidasi. Masih ingatkah pembahasan kita sebelumnya tentang penentuan bilangan oksidasi? Bilangan oksidasi merupakan besarnya bilangan atau angka yang menunjukkan kekuatan suatu atom untuk menangkap atau melepaskan elektron dalam pembentukan suatu senyawa. Penentuan bilangan oksidasi mengacu pada aturan-aturan tertentu. Baiklah, tentu kalian semua telah mengingat kembali hal-hal yang perlu kalian pahami sebagai modal dasar dalam mempelajari topik ini yaitu menentukan hasil oksidasi dan reduksi.
Menentukan Hasil Oksidasi dan Reduksi
Hasil oksidasi adalah zat yang dihasilkan pada reaksi yang mengalami oksidasi.
Hasil reduksi adalah zat yang dihasilkan pada reaksi yang mengalami reduksi.
Langkah-Langkah Menentukan Hasil Reduksi Oksidasi
1. Menentukan bilangan oksidasi masing-masing unsur yang mengalami perubahan pada reaksi redoks.
2. Menentukan reaksi reduksi dan oksidasi pada reaksi redoks tersebut.
3. Menentukan hasil reduksi dan oksidasi.
Reaksi reduksi adalah reaksi penurunan bilangan oksidasi, sedangkan reaksi oksidasi adalah reaksi kenaikan bilangan oksidasi. Pada beberapa reaksi redoks, zat-zat yang bertindak sebagai reduktor dan oksidator merupakan zat sama sehingga dinamakan reaksi autoredoks. Reduktor merupakan zat yang mengalami oksidasi sedangkan oksidator merupakan zat yang mengalami reduksi. Untuk memahami mana reaksi yang mengalami reduksi dan oksidasi, kita wajib mengetahui konsep penentuan bilangan oksidasi. Masih ingatkah pembahasan kita sebelumnya tentang penentuan bilangan oksidasi? Bilangan oksidasi merupakan besarnya bilangan atau angka yang menunjukkan kekuatan suatu atom untuk menangkap atau melepaskan elektron dalam pembentukan suatu senyawa. Penentuan bilangan oksidasi mengacu pada aturan-aturan tertentu. Baiklah, tentu kalian semua telah mengingat kembali hal-hal yang perlu kalian pahami sebagai modal dasar dalam mempelajari topik ini yaitu menentukan hasil oksidasi dan reduksi.
Menentukan Hasil Oksidasi dan Reduksi
Hasil oksidasi adalah zat yang dihasilkan pada reaksi yang mengalami oksidasi.
Hasil reduksi adalah zat yang dihasilkan pada reaksi yang mengalami reduksi.
Langkah-Langkah Menentukan Hasil Reduksi Oksidasi
1. Menentukan bilangan oksidasi masing-masing unsur yang mengalami perubahan pada reaksi redoks.
2. Menentukan reaksi reduksi dan oksidasi pada reaksi redoks tersebut.
3. Menentukan hasil reduksi dan oksidasi.
Contoh soal
Tentukan hasil reduksi dan oksidasi pada reaksi berikut.
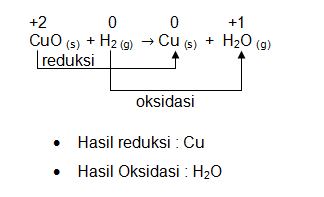
CuO (s) + H2 (g) → Cu (s) + H2O (g)
Tentukan hasil reduksi dan oksidasi pada reaksi berikut.
CuO (s) + H2 (g) → Cu (s) + H2O (g)
Penyelesaian
Mari kita perhatikan langkah- langkah dalam penentuan hasil reduksi dan oksidasi:
1. menentukan bilangan oksidasi masing-masing unsur yang mengalami perubahan pada reaksi redoks;
2. menentukan reaksi reduksi dan oksidasi pada reaksi redoks tersebut; dan
3. menentukan hasil reduksi dan oksidasi.
Mari kita perhatikan langkah- langkah dalam penentuan hasil reduksi dan oksidasi:
1. menentukan bilangan oksidasi masing-masing unsur yang mengalami perubahan pada reaksi redoks;
2. menentukan reaksi reduksi dan oksidasi pada reaksi redoks tersebut; dan
3. menentukan hasil reduksi dan oksidasi.

Pada rekasi di atas, zat yang mengalami penurunan biloks adalah Cu dari senyawa CuO yaitu dari +2 menjadi 0 sehingga hasil reduksinya adalah Cu. Sedangkan unsur yang mengalami kenaikan biloks adalah H sehingga hasil oksidasinya H2O. Contoh fenomena sehari-hari yang melibatkan reaksi redoks adalah terbentuknya korosi.
S1
Hasil oksidasi pada reaksi Mg (s) + 2 HCl (aq) → MgCl2 (aq) + H2(g) adalah…
S2
Hasil reduksi dari persamaan Cu (s) + HNO3 (aq) → Cu (NO3)2 (aq) + NO (g) + H2O (l) adalah..
S3
Hasil oksidasi dari persamaan 2 Al (s) + 3 H2O (g) → Al2O3 (s) + 3 H2 (g) adalah….
S4
Hasil oksidasi dari persamaan 2 AgCl (s) + Ca (s) → CaCl2 (s) + 2 Ag (s) adalah….
S5
Hasil reduksi dan oksidasi pada reaksi Zn (s) + 2 HCl (aq) → ZnCl2 (aq) + H2 (g) adalah....
S6
Hasil oksidasi dan hasil reduksi yang sama terdapat pada persamaan reaksi…
S7
Reaksi berikut ini yang tidak mempunyai zat hasil reduksi adalah....
S8
Reaksi berikut ini yang tidak mempunyai zat hasil oksidasi adalah....
S9
Hasil reduksi dari reaksi H2S (g) + Cl2 (g) → 2 HCl (g) + S (s) adalah….
10
Hasil oksidasi dari reaksi P4 (s) + 6 Cl (g) → 4 PCl3(l) adalah….
