Contoh Soal Grafik titrasi asam basa
Contoh Soal Grafik titrasi asam basa - Pada topik sebelumnya kita telah mempelajari tentang titrasi. Untuk mengingat kembali topik titrasi, berikut disampaikan ikhtisar umum tentang titrasi.
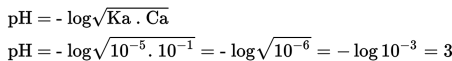
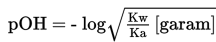
3. Titik Setelah Titrasi
Penambahan NaOH yang berlebih, akan menyebabkan larutan kelebihan mol NaOH, sehingga larutan akan bersifat basa dengan pH > 7.
Perhitungan pH menggunakan rumus pOH = -log [OHsisa].
Kurva titrasi yang terjadi digambarkan seperti berikut.
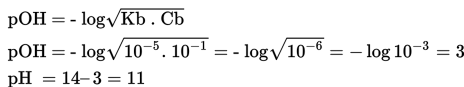
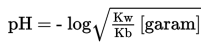
3. Titik Setelah Titrasi
Penambahan HCl yang berlebih, akan menyebabkan larutan kelebihan mol HCl, sehingga larutan akan bersifat asam dengan pH < 7.
Perhitungan pH menggunakan rumus berikut.
pH = -log[H+sisa].
Kurva titrasi yang terjadi digambarkan seperti berikut.
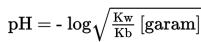
3. Titik Setelah Titrasi
Penambahan NH4OH yang berlebih, akan membentuk larutan buffer atau larutan penyangga. Sifat larutan ini adalah basa, sehinngga pH larutan lebih besar dari 7. Hasil didapatkan dari perbandingan mol sisa dari basa lemah dengan garam. Perhitungan pH digunakan rumus berikut.
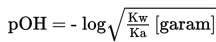
3. Titik Setelah Titrasi
Penambahan CH3COOH 0,1 M secara berlebih akan membentuk larutan buffer atau larutan penyangga. Sifat larutan ini adalah asam, maka pH larutan lebih kecil dari 7. pH didapatkan melalui perbandingan mol sisa dari asam lemah dengan garam, secara matematis dituliskan sebagai berikut.
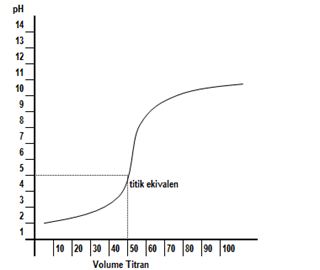
Titrasi adalah suatu metode analisa kuantitatif untuk menetralkan asam dan basa. Tujuan utama titrasi adalah untuk menentukan konsentrasi asam atau basa. Proses titrasi dilakukan dengan cara menambahkan larutan baku (larutan yang telah diketahui dengan tepat konsentrasinya) ke dalam larutan lain dengan bantuan indikator sampai tercapai titik ekuivalen.
Titrasi dihentikan tepat pada saat jumlah mol H+ setara dengan jumlah mol OH-. Pada saat itu larutan bersifat netral dan berada di titik ekuivalen. Titik ekuivalen dapat diamati menggunakan indikator yang memiliki daerah kerja di sekitar titik tersebut. Perubahan warna menandakan terbentuknya titik akhir titrasi. Pada topik ini, kita akan mempelajari tentang kurva titrasi, cara menggambarkan dan menganalisanya.
Titrasi dihentikan tepat pada saat jumlah mol H+ setara dengan jumlah mol OH-. Pada saat itu larutan bersifat netral dan berada di titik ekuivalen. Titik ekuivalen dapat diamati menggunakan indikator yang memiliki daerah kerja di sekitar titik tersebut. Perubahan warna menandakan terbentuknya titik akhir titrasi. Pada topik ini, kita akan mempelajari tentang kurva titrasi, cara menggambarkan dan menganalisanya.
1. Pengertian Kurva Titrasi
Kurva titrasi adalah grafik yang menyatakan pH dan jumlah larutan standar yang ditambahkan. Kurva titrasi diperoleh dari percobaan titrasi. Apabila suatu asam yang pHnya kurang dari 7 ditambah dengan basa yang pH–nya lebih dari 7, maka pH asam akan naik, sebaliknya suatu basa ditambahi asam, maka pH basa akan turun. Apabila penambahan zat dilakukan tetes demi tetes kemudian dihitung pH–nya maka kita akan memperoleh hubungan antara perubahan pH dengan jumlah tetes (volume) zat yang ditambahkan. Hubungan antara keduanya, bila dituangkan dalam bentuk kurva, maka akan kita peroleh kurva titrasi.
2. Penggambaran Kurva Titrasi
Sebagaimana telah disebutkan di atas, bahwa kurva titrasi adalah kurva yang menunjukkan hubungan pH larutan dan volume titran. Kurva ini dapat dibuat secara teoritis dengan menghitung pH larutan titrat, yaitu larutan yang dianalisa/ larutan yang diberi larutan standar. Perhitungan pH dapat dilakukan pada titik awal sebelum penambahan titran, titik setelah ditambah titran, titik ekuivalen yaitu saat larutan netral (tanpa kelebihan asam dan basa), dan daerah lewat ekuivalen. Kurva titrasi akan dipengaruhi oleh kekuatan asam atau basa yang digunakan, untuk memperjelas tentang hal ini, mari perhatikan jenis-jenis titrasi dilihat dari kekuatan asam dan basa.
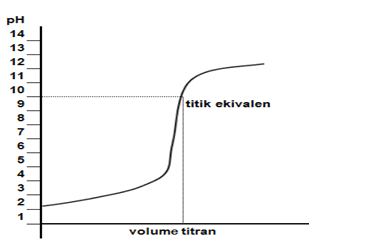
a. Titrasi Asam Kuat oleh Basa Kuat
Titrasi antara 50 mL HCl 0,1 M dengan 50 mL NaOH 0,1 M.
Perhitungan pH hanya dilakukan pada larutan analit atau larutan titrat.
1. pH Sebelum Titrasi
Sebelum titrasi hanya terdapat 50 mL HCl 0,1 M
pH = -log [H+]
pH = -log 10-1 = 1
Perhitungan pH hanya dilakukan pada larutan analit atau larutan titrat.
1. pH Sebelum Titrasi
Sebelum titrasi hanya terdapat 50 mL HCl 0,1 M
pH = -log [H+]
pH = -log 10-1 = 1
2. pH pada Titik Ekivalen
Pada titik ekivalen, terbentuk garam yang tidak bisa di hidrolisa oleh air, sehingga bersifat netral dan pH = 7. Reaksi yang terjadi
HCl + NaOH→ NaCl + H2O
NaCl→ Na+ + Cl-
Na+ + H2O → tidak terjadi reaksi
Cl- + H2O → tidak terjadi reaksi
Pada titik ekivalen, terbentuk garam yang tidak bisa di hidrolisa oleh air, sehingga bersifat netral dan pH = 7. Reaksi yang terjadi
HCl + NaOH→ NaCl + H2O
NaCl→ Na+ + Cl-
Na+ + H2O → tidak terjadi reaksi
Cl- + H2O → tidak terjadi reaksi
3. pH setelah titik ekivalen
Pada penambahan NaOH selanjutnya akan membuat pH semakin meningkat dari konsentrasi 10-7 M menjadi 10-3 M hanya dengan penambahan 5 mL NaOH. Perhitungan pH menggunakan rumus: pOH = - log [OH- sisa].
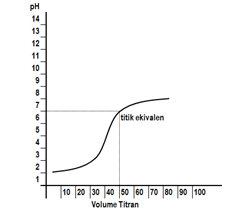
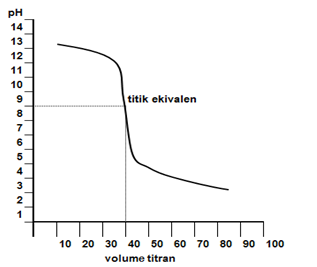
Kurva titrasinya sebagai berikut.
Pada penambahan NaOH selanjutnya akan membuat pH semakin meningkat dari konsentrasi 10-7 M menjadi 10-3 M hanya dengan penambahan 5 mL NaOH. Perhitungan pH menggunakan rumus: pOH = - log [OH- sisa].
Kurva titrasinya sebagai berikut.

Indikator yang bisa dipakai adalah fenolftalein, bromotimol biru, dan metil merah untuk titrasi asam kuat oleh basa kuat. Hal tersebut karena pH = 7 berada pada kisaran indikator tersebut.
b. Titrasi Basa Kuat oleh Asam Kuat
Titrasi antara 50 mL larutan NaOH 0,1 M dengan 50 mL HCl 0,1 M.
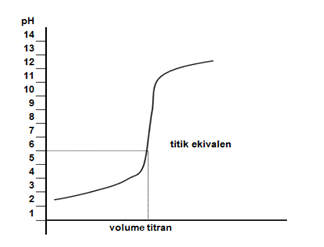
Seperti pada titrasi asam kuat oleh basa kuat, titik ekuivalen titrasi ini pada saat penambahan HCl sebanyak 50 mL dan pH = 7. Indikator yang bisa dipakai adalah fenolftalein, bromotimol biru, dan metil merah.
1. pH sebelum titrasi
Sebelum titrasi hanya terdapat 50 mL NaOH 0,1 M
pOH = - log [OH-]
pOH = - log [10-1] = 1, sehingga pH = 14 – 1 = 13
2. pH pada titik ekivalen
Pada titik ekivalen, terbentuk garam yang tidak bisa di hidrolisa oleh air, sehingga bersifat netral dan pH = 7. Reaksi yang terjadi
HCl + NaOH→ NaCl + H2O
NaCl→ Na+ + Cl-
Na+ + H2O → tidak terjadi reaksi
Cl- + H2O → tidak terjadi reaksi
Seperti pada titrasi asam kuat oleh basa kuat, titik ekuivalen titrasi ini pada saat penambahan HCl sebanyak 50 mL dan pH = 7. Indikator yang bisa dipakai adalah fenolftalein, bromotimol biru, dan metil merah.
1. pH sebelum titrasi
Sebelum titrasi hanya terdapat 50 mL NaOH 0,1 M
pOH = - log [OH-]
pOH = - log [10-1] = 1, sehingga pH = 14 – 1 = 13
2. pH pada titik ekivalen
Pada titik ekivalen, terbentuk garam yang tidak bisa di hidrolisa oleh air, sehingga bersifat netral dan pH = 7. Reaksi yang terjadi
HCl + NaOH→ NaCl + H2O
NaCl→ Na+ + Cl-
Na+ + H2O → tidak terjadi reaksi
Cl- + H2O → tidak terjadi reaksi
3. pH setelah titik ekivalen
Pada penambahan HCl selanjutnya akan membuat pH semakin menurun. Perhitungan pH menggunakan rumus: pH = -log [H+sisa]
Pada penambahan HCl selanjutnya akan membuat pH semakin menurun. Perhitungan pH menggunakan rumus: pH = -log [H+sisa]
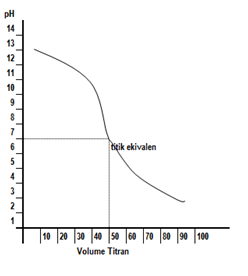
Kurva titrasinya digambarkan sebagai berikut.

c. Titrasi Asam Lemah oleh Basa Kuat
Titrasi antara 50 mL asam lemah CH3COOH 0,1 M (Ka = 10-5) dengan larutan basa kuat NaOH 0,1 M.
1. pH Sebelum Titrasi
Sebelum titrasi hanya terdapat 50 mL asam lemah CH3COOH 0,1 M (Ka = 10-5 ). pH dihitung sebagai
1. pH Sebelum Titrasi
Sebelum titrasi hanya terdapat 50 mL asam lemah CH3COOH 0,1 M (Ka = 10-5 ). pH dihitung sebagai
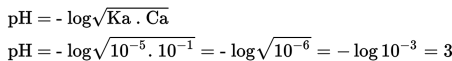
2. Pada titik ekivalen titrasi akan terbentuk larutan yang dapat dihidrolisa
Reaksinya sebagai berikut.
CH3COOH + NaOH → CH3COONa + H2O
CH3COONa → CH3COO- + Na+
Reaksinya sebagai berikut.
CH3COOH + NaOH → CH3COONa + H2O
CH3COONa → CH3COO- + Na+
Reaksi hidrolisa
Na+ + H2O → tidak terjadi reaksi
CH3COO- + H2O + CH3COOH + OH-
Pada reaksi tersebut terbentuk ion OH-, maka larutan pada titik ekivalen akan bersifat basa dengan pH > 7.
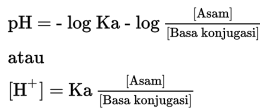
Perhitungan pH menggunakan rumus berikut.
Na+ + H2O → tidak terjadi reaksi
CH3COO- + H2O + CH3COOH + OH-
Pada reaksi tersebut terbentuk ion OH-, maka larutan pada titik ekivalen akan bersifat basa dengan pH > 7.
Perhitungan pH menggunakan rumus berikut.
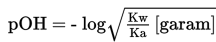
3. Titik Setelah Titrasi
Penambahan NaOH yang berlebih, akan menyebabkan larutan kelebihan mol NaOH, sehingga larutan akan bersifat basa dengan pH > 7.
Perhitungan pH menggunakan rumus pOH = -log [OHsisa].
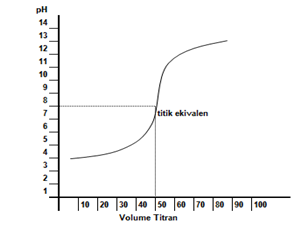
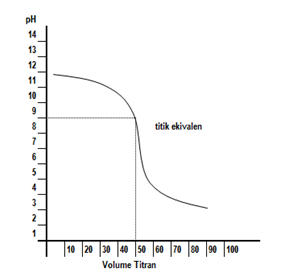
Kurva titrasi yang terjadi digambarkan seperti berikut.

Dari kurva di atas terlihat bahwa titik ekuivalen titrasi >7. Hal ini disebabkan garam yang terbentuk mengalami hidrolisis sebagian yang bersifat basa. Indikator yang bisa digunakan adalah bromotimol biru dan fenolftalein.
d. Titrasi Basa Lemah oleh Asam Kuat
Titrasi antara 50 mL NH4OH 0,1 M (Kb = 10-5) dengan HCl 0,1 M.
1. pH Sebelum Titrasi
Sebelum titrasi hanya terdapat 50 mL NH4OH 0,1 M (Kb = 10-5). pH dihitung sebagai berikut.
1. pH Sebelum Titrasi
Sebelum titrasi hanya terdapat 50 mL NH4OH 0,1 M (Kb = 10-5). pH dihitung sebagai berikut.
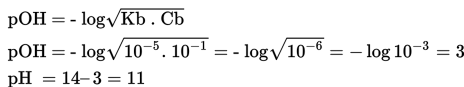
Kemudian saat berada pada titik ekuivalen, akan tercapai kondisi berikut.
2. pH pada Titik Ekivalen
Pada titik ekivalen titrasi ini terbentuk larutan yang dapat dihidrolisa. Reaksinya sebagai berikut.
NH4OH + HCl → NH4Cl + H2O
NH4Cl → NH4+ + Cl-
2. pH pada Titik Ekivalen
Pada titik ekivalen titrasi ini terbentuk larutan yang dapat dihidrolisa. Reaksinya sebagai berikut.
NH4OH + HCl → NH4Cl + H2O
NH4Cl → NH4+ + Cl-
Reaksi hidrolisa
Cl- + H2O → tidak terjadi reaksi
NH4+ + H2O → NH4OH + H+
Pada reaksi di atas, terbentuk H+, maka larutan pada titik ekivalen akan bersifat asam dengan pH < 7. Perhitungan pH menggunakan rumus berikut.
Cl- + H2O → tidak terjadi reaksi
NH4+ + H2O → NH4OH + H+
Pada reaksi di atas, terbentuk H+, maka larutan pada titik ekivalen akan bersifat asam dengan pH < 7. Perhitungan pH menggunakan rumus berikut.
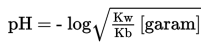
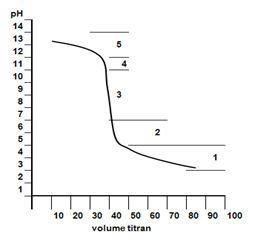
3. Titik Setelah Titrasi
Penambahan HCl yang berlebih, akan menyebabkan larutan kelebihan mol HCl, sehingga larutan akan bersifat asam dengan pH < 7.
Perhitungan pH menggunakan rumus berikut.
pH = -log[H+sisa].
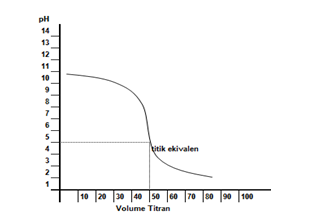
Kurva titrasi yang terjadi digambarkan seperti berikut.

Dari kurva tersebut, terlihat bahwa titik ekuivalen terjadi pada pH lebih kecil 7. Hal ini disebabkan garam yang terbentuk mengalami hidrolisis sebagian yang bersifat asam. Adapun indikator asam basa yang bisa digunakan sebagai indikator titrasi adalah metil merah dan bromotimol biru.
e. Titrasi Asam Kuat oleh Basa Lemah
Titrasi antara 50 mL HCl 0,1 M dengan 50 mL NH4OH 0,1 M (Kb = 10-5).
1. pH Sebelum Titrasi
Sebelum titrasi hanya terdapat 50 mL HCl 0,1 M
pH = -log[H+]
pH = -log[10-1] = 1
2. pH pada Titik Ekivalen
Pada titik ekivalen titrasi ini terbentuk larutan yang dapat dihidrolisa. Reaksinya sebagai berikut.
NH4OH + HCl → NH4Cl + H2O
NH4Cl → NH4+ + Cl-
1. pH Sebelum Titrasi
Sebelum titrasi hanya terdapat 50 mL HCl 0,1 M
pH = -log[H+]
pH = -log[10-1] = 1
2. pH pada Titik Ekivalen
Pada titik ekivalen titrasi ini terbentuk larutan yang dapat dihidrolisa. Reaksinya sebagai berikut.
NH4OH + HCl → NH4Cl + H2O
NH4Cl → NH4+ + Cl-
Reaksi hidrolisa
Cl- + H2O → tidak terjadi reaksi
NH4+ +H2O →NH4OH + H+
Pada reaksi hidrolisa di atas terbentuk ion H+, maka larutan pada titik ekivalen akan bersifat asam dengan pH < 7. Perhitungan pH menggunakan rumus berikut.
Cl- + H2O → tidak terjadi reaksi
NH4+ +H2O →NH4OH + H+
Pada reaksi hidrolisa di atas terbentuk ion H+, maka larutan pada titik ekivalen akan bersifat asam dengan pH < 7. Perhitungan pH menggunakan rumus berikut.
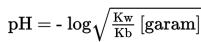
3. Titik Setelah Titrasi
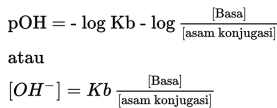
Penambahan NH4OH yang berlebih, akan membentuk larutan buffer atau larutan penyangga. Sifat larutan ini adalah basa, sehinngga pH larutan lebih besar dari 7. Hasil didapatkan dari perbandingan mol sisa dari basa lemah dengan garam. Perhitungan pH digunakan rumus berikut.

Kurva titrasi yang terjadi digambarkan seperti berikut.

f. Titrasi Basa Kuat oleh Asam Lemah
Titrasi antara 50 mL NaOH 0,1 M dengan 50 mL asam lemah CH3COOH 0,1 M (Ka = 10-5).
1. pH Sebelum Titrasi
Sebelum titrasi hanya terdapat 50 mL NaOH 0,1 M
pOH = -log [OH-]
POH = -log [10-1] = 1, sehingga pH = 14 – 1 = 13
2. pH pada Titik Ekivalen
Pada titik ekivalen titrasi ini terbentuk larutan yang dapat dihidrolisa. Reaksinya sebagai berikut.
CH3COOH + NaOH → CH3COOH + H2O
CH3COONa → CH3COO- + Na+
1. pH Sebelum Titrasi
Sebelum titrasi hanya terdapat 50 mL NaOH 0,1 M
pOH = -log [OH-]
POH = -log [10-1] = 1, sehingga pH = 14 – 1 = 13
2. pH pada Titik Ekivalen
Pada titik ekivalen titrasi ini terbentuk larutan yang dapat dihidrolisa. Reaksinya sebagai berikut.
CH3COOH + NaOH → CH3COOH + H2O
CH3COONa → CH3COO- + Na+
Reaksi hidrolisa
Na+ + H2O → tidak terjadi reaksi
CH3COO- + H2O → CH3COOH + OH-
Na+ + H2O → tidak terjadi reaksi
CH3COO- + H2O → CH3COOH + OH-
Pada rekasi hidrolisa di atas, terbentuk OH-, maka larutan pada titik ekivalen akan bersifat basa dengan pH > 7.
Perhitungan pH menggunakan rumus berikut.
Perhitungan pH menggunakan rumus berikut.
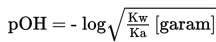
3. Titik Setelah Titrasi
Penambahan CH3COOH 0,1 M secara berlebih akan membentuk larutan buffer atau larutan penyangga. Sifat larutan ini adalah asam, maka pH larutan lebih kecil dari 7. pH didapatkan melalui perbandingan mol sisa dari asam lemah dengan garam, secara matematis dituliskan sebagai berikut.

Kurva titrasi yang terjadi digambarkan seperti berikut.

S1
Kurva titrasi adalah kurva yang menggambarkan hubungan antara....
S2
Pada titrasi asam kuat dengan basa kuat, akan diperoleh larutan dengan pH =7. Hal ini terjadi karena larutan yang terbentuk ....
S3
Pada titrasi asam kuat dengan basa lemah, bila ditambahkan basa lemah secara terus menerus sampai melewati titik ekivalen, akan dihasilkan zat yang bersifat basa. Hal ini terjadi karena ....
S4
Jika 50 mL NH4OH (Kb =10-5) dititrasi dengan 50 mL HCl 0,1 M, maka pada akhir titrasi, akan diperoleh pH larutan sebesar.... (log 0,7 = –0,15)
S5
10 mL NaOH 0,2 M dititrasi dengan asam asetat 0,2 M (Ka =10-6). Saat penambahan 20 mL asam asetat, ternyata reaksi telah melewati titik ekivalen. Harga pH larutan setelah melewati titik ekivalen adalah ....
S6
Perhatikan kurva titrasi berikut.

Kurva di atas merupakan bentuk hasil titrasi antara....
S7
Pada titrasi 10 mL HCl 0,5 M dengan NH4OH 0,1 M (Kb = 10-5) diperoleh kurva titrasi sebagai berikut.

Berdasarkan kurva di atas, volume titran yang dibutuhkan adalah....
S8
Perhatikan kurva titrasi berikut.

Daerah terbentuknya larutan penyangga adalah ....
S9
10 mL NaOH 0,1 M dititrasi dengan 10 mL HBr 0,001 M. pH larutan titrat sebelum dititrasi adalah ....
S10
Perhatikan kurva titrasi berikut.

Rentang pH Indikator yang tepat untuk mengukur titrasi tersebut adalah ....
