Contoh Soal Kalkulasi Ekuilibrium
Contoh Soal Kalkulasi Ekuilibrium - Ada dua bentuk konstanta ekuilibrium:
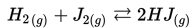
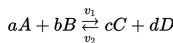
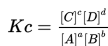
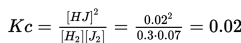
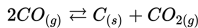
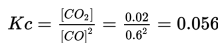
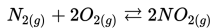
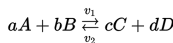
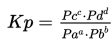
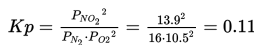
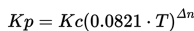
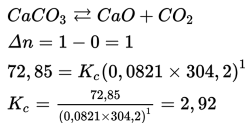
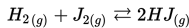
persen reaksi adalah korelasi antara hasil penghitungan produk pada ekuilibrium dan hasil maksimum yang masuk akal dari produk.
1.56 m m o l / l 2 m m o l / l ⋅ 100 % = 78 %
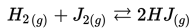
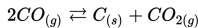
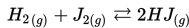
2 ( g ) + 2 O 2 ( g ) ⇄ 2 N O 2 ( g )
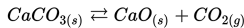
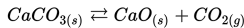
Kc menunjukkan besaran ekuilibrium yang merupakan konsentrasi dalam mol/dm3.
Kp menunjukkan besaran ekuilibrium yang merupakan tekanan sebagian (atm or Pa).
Kalkulasi atau penghitungan yang menggunakan konstanta ekuilibrium akan dijelaskan melalui contoh.
Contoh 1:
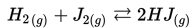
Jika [H2]= 0.3 M, [J2]=0.07 M dan [HJ]= 0.02 M, maka apakah konstanta ekuilibrium (Kc), untuk reaksi ini?
Jawaban:
Contoh umum untuk reaksi reversibel adalah
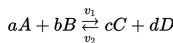
dan persamaan konstanta ekuilibrium adalah:
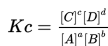
A dan B adalah reaktan, C dan D adalah produk reaksi, v1 adalah kecepatan reaksi langsung, v2 adalah kecepatan reaksi tidak langsung. a, b, c, d adalah koefisien stoikiometrik.
Persamaan konstanta ekuilibrium untuk reaksi di atas adalah:
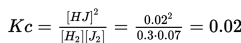
Contoh 2:
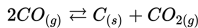
Jika [CO]= 0.6 M, [C]=0.05 M dan [CO2]= 0.02 M, apakah konstanta ekuilibrium (Kc), untuk reaksi ini?
Konsentrasi solid tidak mempengaruhi konstan ekuilibrium. Jadi, persamaan konstanta ekuilibrium dalam reaksi ini adalah:
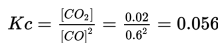
Contoh 3:
Jika tekanan sebagian untuk PN2=16 kPa, PO2=10.5 kPa, dan PNO2=13.9 kPa, apakah konstanta ekuilibrium (Kp), untuk persamaan berikut?
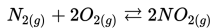
Jawaban:
Contoh umum untuk reaksi reversibel adalah:
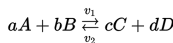
dan persamaan konstanta ekuilibrium adalah:
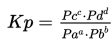
Jadi,
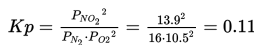
Hubungan antara Kc dan Kp adalah:
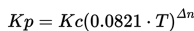
Δn - perbedaan antara jumlah mol reaktan dan produk reaksi.
T- temperatur dalam Kelvin (K)
Contoh:
Pada temperatur T=304.2 K, tekanan parsial PCO2=72,85 atm, hitunglah
Kc untuk persamaan berikut.
Kc untuk persamaan berikut.
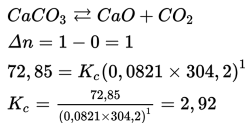
Contoh 5:
Hitunglah persen reaksi.
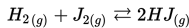
Jika [H2]=1 mmol/l dan [J2]=1 mmol/l, secara teori diprediksikan bahwa 2mmo/l HJ terbentuk pada reaksi ini, namun kenyataannya hasilnya adalah 1.56mmol/l.
Jawaban:
jadi,persen reaksi adalah korelasi antara hasil penghitungan produk pada ekuilibrium dan hasil maksimum yang masuk akal dari produk.
Jika persen reaksi <1% maka tidak ada reaksi.
Jika persen reaksi >99% maka ini adalah reaksi satu arah ( ireversibel ).
Jika persen reaksi <50%maka ekuilibrium bergeser ke arah reaktan.
Jika persen reaksi >50% maka ekuilibrium bergeser ke arah produk.
S1
Bagaimanakah besaran konstanta ekuilibrium Kp dijabarkan?
S2
Jika [H2]=
0.4 M, [J2]=0.03 M dan [HJ]= 0.04 M, apakah konstanta ekuilibrium (Kc) untuk reaksi berikut?
0.4 M, [J2]=0.03 M dan [HJ]= 0.04 M, apakah konstanta ekuilibrium (Kc) untuk reaksi berikut?
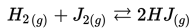
S3
Jika [CO]=
0.3 M, [C]=0.04 M dan [O2] = 0.03 M, apakah konstanta ekuilibrium (Kc) untuk reaksi di bawah ini?
0.3 M, [C]=0.04 M dan [O2] = 0.03 M, apakah konstanta ekuilibrium (Kc) untuk reaksi di bawah ini?
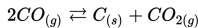
S4
Jika [H2]=1 mmol/l dan [J2]=1
mmol/l, secara teori diperkirakan bahwa 2mmol/l HJ dibentuk dalam reaksi ini, namun hasilnya hanya 1.58mmol/l. Hitunglah persen reaksi.
mmol/l, secara teori diperkirakan bahwa 2mmol/l HJ dibentuk dalam reaksi ini, namun hasilnya hanya 1.58mmol/l. Hitunglah persen reaksi.
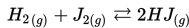
S5
Perhatikan reaksi berikut.
Jika tekanan parsial untuk {P_{{N_2}}} = 15\,{\rm{kPa}}\, {P_{{O_2}}} = 18,5\,{\rm{kPa}}\, dan {P_{{NO_2}}} = 15,9\,{\rm{kPa}}\, konstanta ekuilibrium
(Kp) untuk reaksi tersebut adalah ....
(Kp) untuk reaksi tersebut adalah ....
6
Hitunglah Kc untuk reaksi berikut jika tekanan parsial Pco2=74.75 atm pada T=304.2 K.
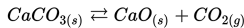
S7
Manakah konsentrasi pada reaksi di bawah ini yang tidak mempengaruhi konstanta ekuilibrium (Kc)?
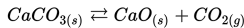
S8
Persen reaksi>50%, artinya _____.
S9
Jika persen reaksi <50%, maka _____.
S10
Jika persen reaksi <1%, artinya _____.
