Contoh Soal Energi Elektron Berdasarkan Teori Bohr
Contoh Soal Energi Elektron Berdasarkan Teori Bohr - Kalian telah mengetahui jari-jari lintasan stasioner (lintasan) elektron. Ingat bahwa elektron berada di lintasan luar pada suatu atom. Akibatnya, elektron tersebut bisa dengan mudah berpindah lintasan. Ketika berpindah lintasan, elektron akan melepaskan (memancarkan) atau menyerap energi. Kalian akan mempelajari energi elektron berdasarkan teori Bohr. Untuk itu, simaklah uraian berikut ini.
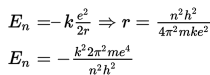
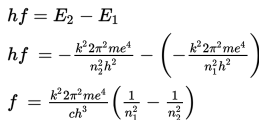
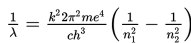
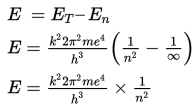
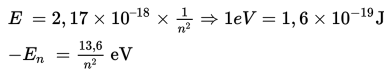
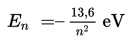
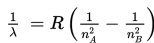
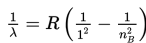
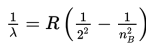
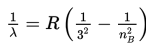
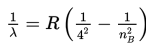
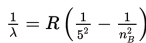
1. Energi Elektron pada Suatu Lintasan
Elektron memiliki energi yang berbeda di setiap lintasan. Saat berpindah lintasan, energi elektron akan menyesuaikan dengan tingkat energi lintasan yang baru. Energi total elektron pada lintasan n dirumuskan sebagai berikut.
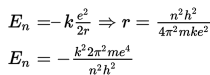
Jika elektron menyerap energi foton dari luar, maka elektron tersebut akan bertransisi ke tingkat energi yang lebih tinggi dan biasa disebut sebagai eksitasi. Dalam keadaan tereksitasi, elektron tidak stabil. Akibatnya, elektron cenderung untuk memancarkan energi. Saat memancarkan energi, elektron tersebut akan kembali ke lintasan semula. Sebagai contoh, jika lintasan elektron dengan n = 1 dan tingkat energi E1 menyerap energi foton sehingga tereksitasi ke lintasan dengan n = 2 dan tingkat energi E2, energi foton yang diserap merupakan selisih kedua tingkat energi lintasan elektron tersebut.
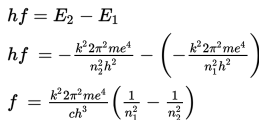
Mengingat c = fλ dan c = 3 × 108 m/s maka persamaannya menjadi berikut ini.
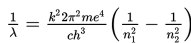
Apabila elektron menyerap energi dari luar, elektron tersebut dapat terpental ke luar lintasan atom (n = ∞). Eksitasi elektron pada n = ∞ dinamakan ionisasi, sedangkan energi yang diserap pada peristiwa tersebut dinamakan energi ionisasi. Elektron yang mengalami ionisasi akan berubah menjadi elektron bebas yang sudah tidak terikat oleh inti atom. Besar energi ionisasi dapat dihitung sebagai berikut.
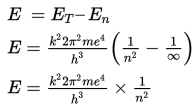
Dengan memasukkan nilai k = 9 × 109 Nm2/C2; m = 9,1 × 10–31 kg; e = 1,6 × 10–19 C; dan h = 6,626 × 10–34 J s, besar energi ionisasi dapat ditentukan sebagai berikut.
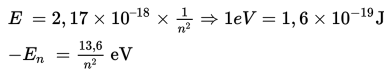
2. Energi Elektron Berdasarkan Teori Bohr
Berdasarkan teori atom Bohr, setiap lintasan elektron mempunyai tingkat energi yang berbeda-beda. Selain itu, elektron dapat berpindah dari tingkat energi satu ke tingkat energi yang lain. Elektron yang paling dekat dengan inti (n = 1) memiliki tingkat energi yang paling rendah.
Jika elektron berpindah ke tempat energi yang rendah, maka electron tersebut akan melepaskan (memancarkan) energi foton sebesar hf. Sebaliknya, jika elektron berpindah ke tingkat energi yang lebih tinggi, maka electron akan menyerap energi. Energi tiap lintasan elektron besarnya sebagai berikut.
Jika elektron berpindah ke tempat energi yang rendah, maka electron tersebut akan melepaskan (memancarkan) energi foton sebesar hf. Sebaliknya, jika elektron berpindah ke tingkat energi yang lebih tinggi, maka electron akan menyerap energi. Energi tiap lintasan elektron besarnya sebagai berikut.
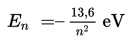
Menurut Bohr, jika elektron atom hidrogen berpindah dari lintasan berenergi tinggi (nB) ke lintasan berenergi rendah (nA), panjang gelombang elektromagnetik yang dipancarkan, dinyatakan sebagai berikut.
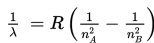
R : konstanta Rydberg (1,097 × 107 /m)
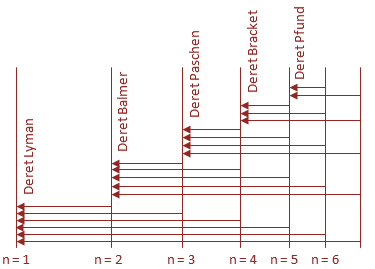
Rincian spektrum atom hidrogen adalah sebagai berikut.
a. Deret Lyman (ultraungu)
Untuk nA = 1 dan nB = 2, 3, 4, ....
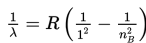
b. Deret Balmer (cahaya tampak)
Untuk nA = 2 dan nB = 3, 4, 5, ....
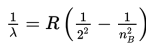
c. Deret Paschen (inframerah I)
Untuk nA = 3 dan nB = 4, 5, 6, ....
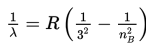
d. Deret Bracket (inframerah II)
Untuk nA = 4 dan nB = 5, 6, 7, ....
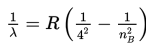
e. Deret Pfund (inframerah III)
Untuk nA = 5 dan nB = 6, 7, 8, ....
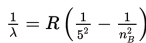

Gambar Rincian spektrum atom hidrogen
3. Percobaan Franck-Hertz
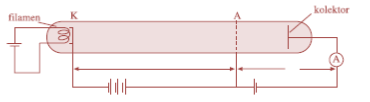
Secara teoretis, tingkat-tingkat energi pada atom hidrogen dapat dijelaskan secara memuaskan dengan teori atom Bohr. Secara eksperimen, adanya tingkat energi elektron ditunjukkan oleh ilmuwan Franck dan Hertz.

Gambar Skema alat percobaan Franck-Hertz
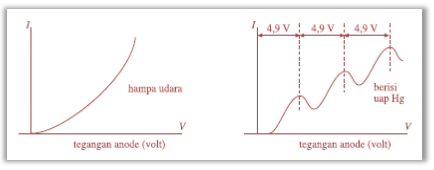
Secara teoritis, Franck dan Hertz telah memahami adanya tingkat-tingkat energi dalam atom. Lalu keduanya berusaha membuktikan kebenaran teori tersebut melalui eksperimen. Anoda dibuat menyerupai kisi (pelat berlubang-lubang). Hal itu dilakukan agar elektron dapat lolos melalui kisi sehingga sampai pada kolektor. Aliran elektron tersebut mengakibatkan amperemeter A teraliri arus listrik. Ketika tegangan anode diperbesar secara periodik, maka arus yang mengalir pada amperemeter ditunjukkan pada gambar berikut.

Gambar Grafik arus yang mengalir pada tegangan anoda
Pada percobaan kedua, tabung diisi dengan uap raksa (Hg). Dengan cara menaikkan tegangan anodae secara periodik, Franck dan Hertz berharap pada tegangan anoda tertentu arus yang mengalir akan turun kemudian naik lagi. Dengan kenaikan tegangan yang sama (ΔV sama), diharapkan diperoleh peristiwa yang sama. Ternyata, hasil eksperimen Franck–Hertz menunjukkan adanya tingkat-tingkat energi dalam atom yang sesuai dengan teori atom Bohr.
Hasil percobaan menunjukkan bahwa setiap kenaikan tegangan kelipatan 4,9 V, arus akan turun. Hal itu menunjukkan bahwa atom Hg hanya mengambil energi dari elektron sebesar 4,9 elektron volt (4,9 eV). Energi sebesar itu akan disimpan sebagai energi dalam atom Hg. Hal tersebut dapat dipahami karena energi elektron bersifat diskret. Jadi, apabila penambahan energi kurang dari 4,9 eV, antara elektron bebas dan elektron yang terikat atom Hg terjadi tumbukan lenting sempurna.
Hasil percobaan menunjukkan bahwa setiap kenaikan tegangan kelipatan 4,9 V, arus akan turun. Hal itu menunjukkan bahwa atom Hg hanya mengambil energi dari elektron sebesar 4,9 elektron volt (4,9 eV). Energi sebesar itu akan disimpan sebagai energi dalam atom Hg. Hal tersebut dapat dipahami karena energi elektron bersifat diskret. Jadi, apabila penambahan energi kurang dari 4,9 eV, antara elektron bebas dan elektron yang terikat atom Hg terjadi tumbukan lenting sempurna.
SOAL 1
Elektron yang memiliki tingkat energi paling rendah terletak di bilangan kuantum ....
SOAL 2
Elektron akan memancarkan energi jika ....
SOAL 3
Besarnya energi foton yang diserap dan dipancarkan elektron bergantung pada ....
SOAL 4
Jika energi elektron pada kulit n = 2 dari atom hidrogen adalah E J, maka energi elektron pada kulit n = 3 adalah ....
SOAL 5
Energi elektron pada keadaan dasar di dalam atom hidrogen adalah –13,6 eV. Energi elektron pada bilangan kuantum n = 4 adalah ....
SOAL 6
Energi elektron atom hidrogen pada keadaan dasar adalah –13,6 eV. Jika elektron mengalami eksitasi dari kulit L ke kulit M, maka besar perubahan energi elektron adalah ....
SOAL 7
Panjang gelombang minimum foton agar terjadi ionisasi pada atom hidrogen adalah ....
SOAL 8
Jika atom memancarkan sinar ultraviolet, maka elektron di dalamnya bertransisi dari ....
SOAL 9
Panjang gelombang foton yang dipancarkan oleh elektron yang berpindah dari lintasan n =3 ke n = 2 adalah ....
SOAL 10
Elektron atom hidrogen berpindah dari lintasan n = 2 ke n = 1. Jika R = 1,097 × 107 /m, panjang gelombang foton yang dipancarkan adalah ...
